Utredning, valg av behandling og behandlingsprinsipper
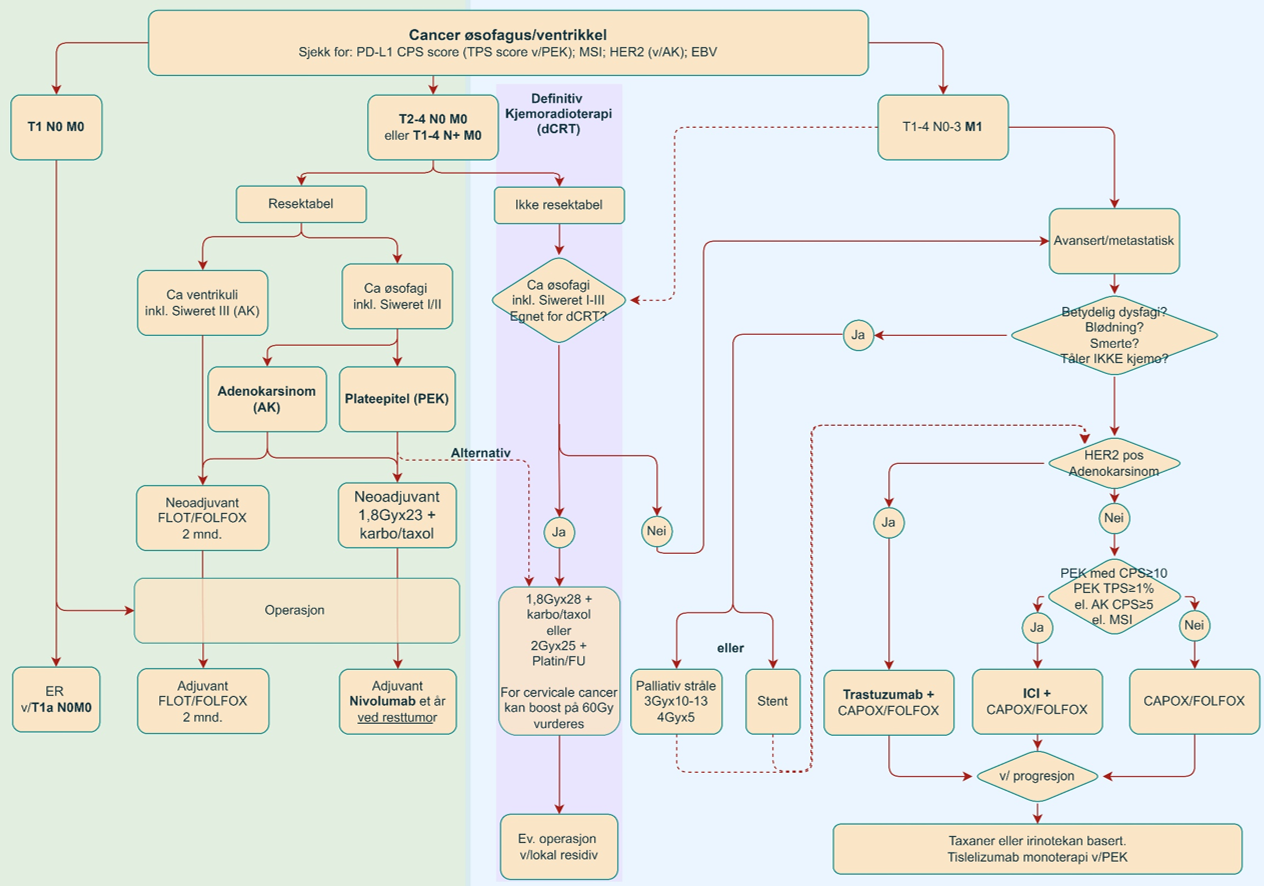
Pasienter med ny diagnostisert kreft eller mistanke om kreft i spiserør og magesekk skal vurderes i tverrfaglig møte på universitetssykehus i pakkeforløp. Den tverrfaglige utredningen skal som et minimum inkludere CT av thorax, abdomen og bekken og øvre endoskopi med biopsi. CT collum, PET, EUS og diagnostisk laparoskopi er aktuelt på utvalgte pasienter. Ved tverrfaglig møte må det tas stilling til følgende:
- Pasientens symptomer.
- Alder, komorbiditet og funksjonsnivå.
- Kreftsykdommens histopatologiske karakteristika inkludert relevante tumormarkører
- Kreftsykdommens omfang i henhold til TNM klassifikasjonen, samt tumors størrelse og makroskopiske karakterista.
- Etablering av behandlingsløp sammen med pasientens ønsker og forventninger til behandling.
Behandling med kurativ intensjon
Som hovedregel behandles kreftsvulster i spiserør og magesekk med organreseksjon og perioperativ onkologisk behandling. Organreseksjonen er øsofagusreseksjon, total-, subtotal gastrektomi eller ventrikkel reseksjon avhengig av lokalisasjon. Perioperativ onkologisk behandling består av enten neoadjuvant radiokjemoterapi eller neoadjuvant og adjuvant kjemoterapi, dette avhenger av svulstens type og lokalisasjon. For utvalgte pasienter er adjuvant immunterapi aktuelt. Det er noen unntak fra ovennevnte:
- Ved dysplasi og utvalgte kreftsvulster begrenset til mucosa og submucosa er behandlingen endoskopisk reseksjon. Organresekksjon eller adjuvant radiokjemoterapi skal vurderes via tverrfaglig møte basert på histopatologisk vurdering av det endoskopiske resektatet, etter endoskopisk reseksjon for plate- og adenokarsinom
- Ved kreftsvulster begrenset til mucosa eller submucosa kan kirurgi uten perioperativ radiokjemoterapi være aktuelt.
- Ved plateepitelcarcinom i spiserør eller GEJ kan definitiv radiokjemoterapi være aktuelt. Unntaksvis kan dette også vurderes på adenokarsinom i samme lokalisasjon.
Pasienter med oligometastatisk sykdom, det vil si begrenset antall metastaser i et organsystem eller ikke-regionale lymfeknutemetastaser på en stasjon, skal vurderes i tverrfaglig møte og reseksjon kan være aktuelt etter systemisk behandling. En forutsetning er at det foreligger stabil sykdom samt god respons på systemisk behandling og at all markoskopisk sykdom kan eksideres eller abladeres.
Det er behov for å styrke evidens for en slik tilnærming og pasientene bør inkluderes i register og/eller studieprotoll.
Behandling med ikke-kurativ intensjon
- Endoskopisk behandling som selvekspanderende stenter
- Palliativ radiokjemoterapi
- Palliativ kirurgi
Kreft i spiserøret og den gastroøsofageale overgang
Anbefalinger
- Operable pasienter med resektable svulster > T1bN0M0 bør tilbyes kirurgi etter vurdering av neoadjuvant kjemoterapi/kjemoradioterapi
- Operable pasienter med resektable Siewert type I og II svulster bør hovedsakelig behandles med øsofagektomi
- Orale reseksjonsmargin bør være minst 5 cm
- Ved øsofagektomi bør det gjøres minimum standard 2-felts lymfadenektomi
Kirurgisk behandling for kreft i spiserøret planlegges nærmest uten unntak i kurativ hensikt. Sykdomsstadium og R0-reseksjon er avgjørende for prognosen. I Norge utføres dette ved et av fire sykehus med regionsansvar. Ved lav risiko spiserørskreft (T1aN0M0) bør det vurderes endoskopisk reseksjon (Noordzij et al., 2019; Pech et al., 2011; Pimentel-Nunes et al., 2022). Ved plateepitelcarcinom (T1aN0M0) bør det vurderes ESD (3). For pasienter med spiserørskreft T1bN0M0 anbefales operasjon direkte. Ved mer avansert stadium anbefales neoadjuvant onkologisk behandling (Allum et al., 2009; Ronellenfitsch et al., 2013; Samson et al., 2016; Shapiro et al., 2015; van Hagen et al., 2012).
Pasienter med T4b svulster (innvekst i organ som trachea eller aorta) eller fjernmetastaser inkludert spredning til ikke–regionale lymfeknuter opereres vanligvis ikke (sistenevnte bør vurderes som oligometastatisk sykdom, se over).
Pasienter med alvorlig komorbiditet, især alvorlig hjerte/lungesykdom, eller sterkt nedsatt funksjon og/eller samarbeidsevne, er vanligvis ikke kandidater for øsofagusreseksjon. Disse kan vurderes for definitiv radiokjemoterapi. Vurdering av lungefunksjon er sentral i vurderingen av operabilitet.
Inndeling av kreft i overgangen spiserør og magesekk
Svulstene i spiserøret kan deles inn i tre kategorier iht lokaliasjon; cervicale svulster, torakale svulster og svulster i den gastroøsofageale overgangen. Siewerts klassifikasjon av svulster i gastroøsofageal overgangen benyttes av mange for planlegging av kirurgisk behandling. Klassifikasjonen baserer seg på tumorsentrums (episenter) lokalisasjon i forhold til gastroøsofageal overgangen.
Type I: Sentrum av tumor lokalisert en til fem cm proksimalt for overgangen
Type II: Sentrum av tumor lokalisert fra en cm proksimalt til to cm distalt for selve overgangen.
Type III: Sentrum av tumor lokalisert to til fem cm distalt for overgangen
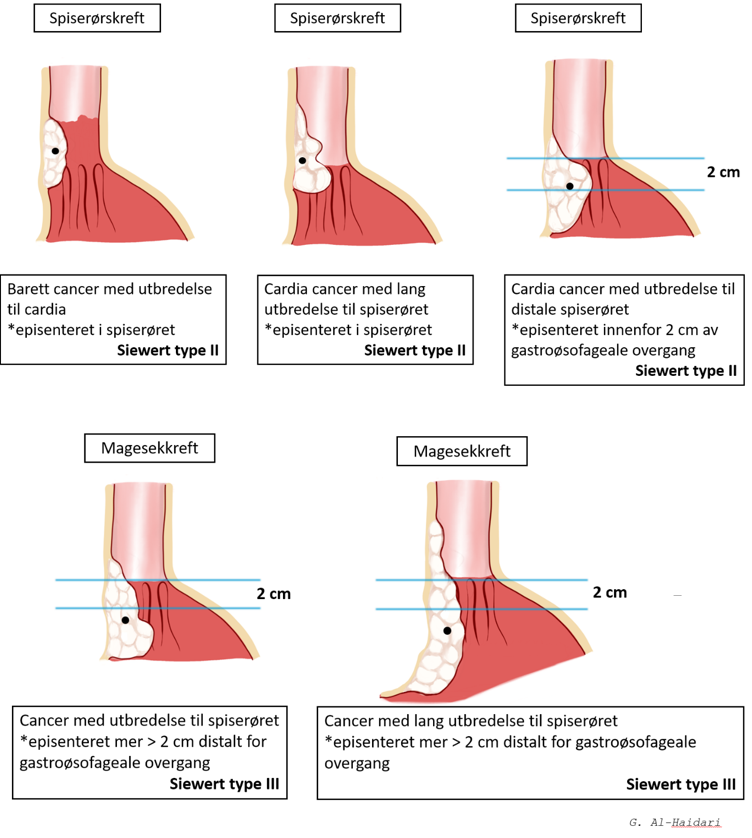
Svulster i gastroøsofageal overgangen er nesten uten unntak adenokarsinomer. Type III behandles vanligvis med total gastrektomi og øsofagojejunostomi, og type I med reseksjon av spiserør og vanligvis øsofagogastrostomi.
Type II svulster behandles primært med øsofagusreseksjon (Kamarajah et al., 2021), men utvidet total gastrektomi kan vurderes.
Operasjonsmetode for kreft i spiserøret
Kreft i torakale del av spiserøret inkludert Siewert I-II ved gastroøsofageal overgangen
Spiserøret fjernes med tilgang via brysthule og bukhulen. I mediastinum utføres disseksjon av øsofagus inkludert regionale lymfeknuter, vanligvis med høyresidig torakotomi eller skopi. Alternativt kan disse pasientene opereres via mellomgulvet (transhiatalt) og jugulum uten torakotomi. Transhiatal øsofagektomi er midlertid assosiert med mindre ekstensiv lymfadenektomi og er dermed først og fremst et alternativ hos pasienter som er lite egnet for transtorakal tilgang grunnet komorbiditet. Hybrid eller total minimal invasiv tilgang (thorakoskopi og/eller laparoskopi, eventuelt robotassistert) anbefales ved øsofagektomi. Hos enkelte pasienter kan det være nødvendig å benytte åpen tilgang. Venstresidig torakolaparotomi er en tilgang som kan vurderes hos pasienter med store svulster i gastroøsofageal overgangen, hvor det er usikker utbredelse til spiserøret og magesekken. Tilgangen gir god oversikt til buken og opp til midtre mediastinum, noe som gjør det mulig å utføre utvidet gastrektomi eller øsofagektomi med intratorakal anastomose. Pasienten ligger i høyre sideleie med svakt posterior tilt, og trenger ikke leies om underveis i operasjonen (Singh et al., 2023).
Ved torakotomi benyttes ofte dobbellumen intubasjonstube med avstengt høyre lunge, ved torakoskopi benyttes ofte singellumen tube med reduserte tidalvolum. Ved disseksjon i mediastinum bør ductus thoracicus identifiserers og forsørges for å redusere risiko for chyluslekkasje. For postoperativ ernæring kan det anlegges et jejunalt ernæringskateter som del av prosedyren.
Ved adenokarcinom, og spesielt plateepitelkarcinom, er det betydelig risiko for submukosal tumorutbredelse. Gode reseksjonsmarginer bør derfor tilstrebes. Orale reseksjonsrand bør være minst 5 cm (Barbour et al., 2007; Niclauss et al., 2019). Reseksjonsmargin for adenokarsinomer mindre enn 3 cm, målt in vivo, er angitt å ha negativ prognostisk betydning.
Som rekonstruksjon etter øsofagektomi benyttes oftest magesekken som anastomoseres til spiserøret, enten i thorax eller på halsen. Alternativt kan man bruke kolon eller tynntarm.
Kreft i cervicale del av spiserøret
I Norge behandles svulster i cervikale øsofagus vanligvis med definitiv radiokjemoterapi. Ved noen internasjonale sentra benyttes fritt transplantat av tynntarm for rekonstruksjonen. Laryngektomi og permanent trakeostomi kan være nødvendig. Dette bør gjøres i samarbeid med ØNH-lege.
Tis | N0
| M0
| Endoskopisk behandling |
T1
| N0
| M0
| T1aN0: endoskopisk behandling T1bN0: kirurgisk eller endoskopisk reseksjon uten onkologisk behandling |
T2-T4a
| N0, N1-N3
| M0 | Kirurgisk behandling med onkologisk behandling |
T4b
| N0, N1-3
| M0
| Definitiv radiokjemoterapi og ev. salvage kirurgi |
T1-4 | N0-3
| M1 | Palliativ onkologisk behandling ev. behandling med kurativ intensjon hos selekterte pasienter innenfor rammen av en studieprotokoll |
Lymfadenektomi ved øsofagusreseksjon
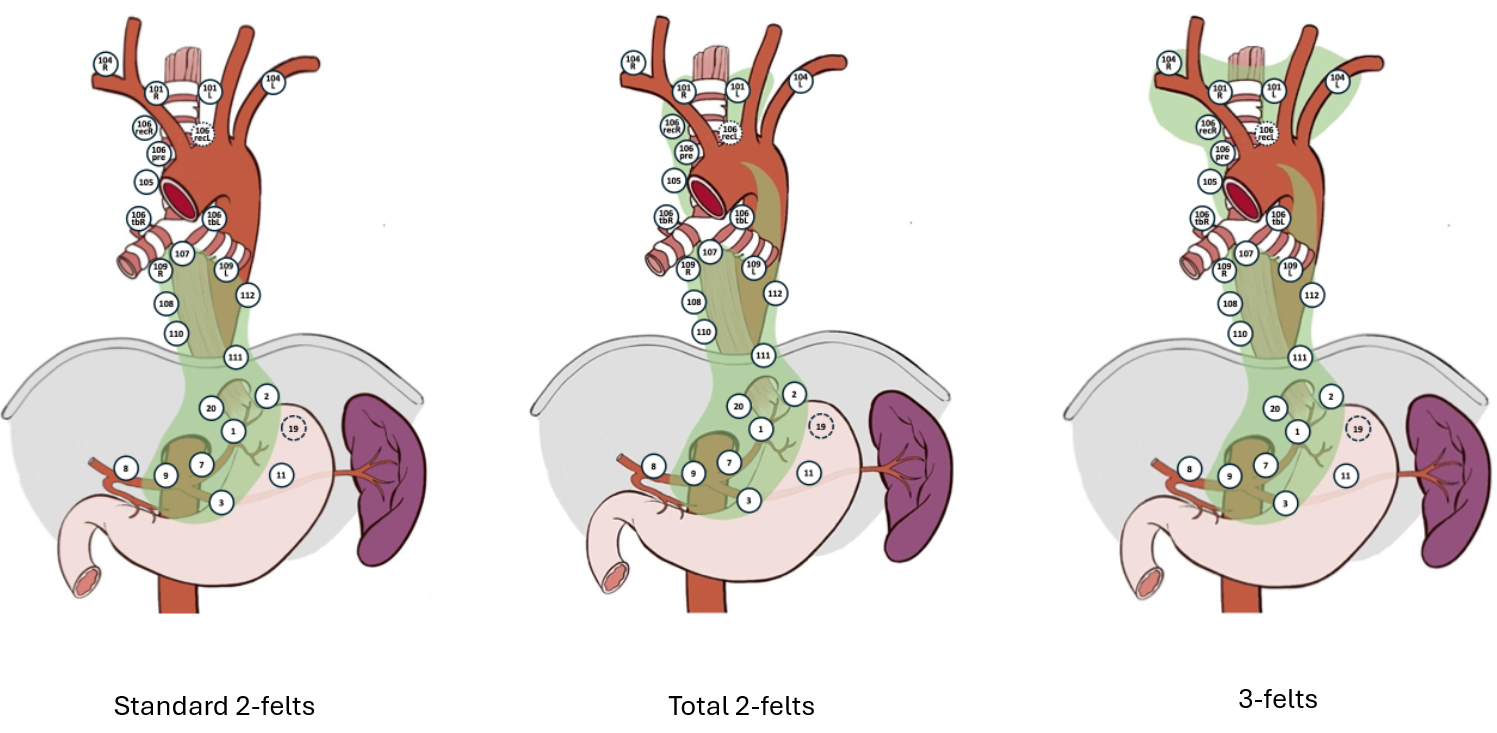
Det anbefales primært standard 2-felts lymfadenektomi (buk og nedre/midtre mediastinum, dvs. tom. carinanivå) (Ma et al., 2014; Ye et al., 2013). Hos utvalgte pasienter er utvidet 2-felts lymfadenektomi aktuelt dvs. inkludert øvre mediastinum, og da særlig eksisjon av lymfeknuter paratrachealt og langs høyre nervus recurrens.
Pasienter med gastroøsofageale svulster hvor utbredelsen i spiserøret er lengre enn 4 cm kan også får utført utvidet 2-felts lymfeadenektomi (Kurokawa et al., 2021). 3-felts lymfadenektomi (buk, mediastinum og hals) er aktuelt på særskilt selekterte pasienter, men dette er assosiert med betydelig komplikasjonsrisiko.
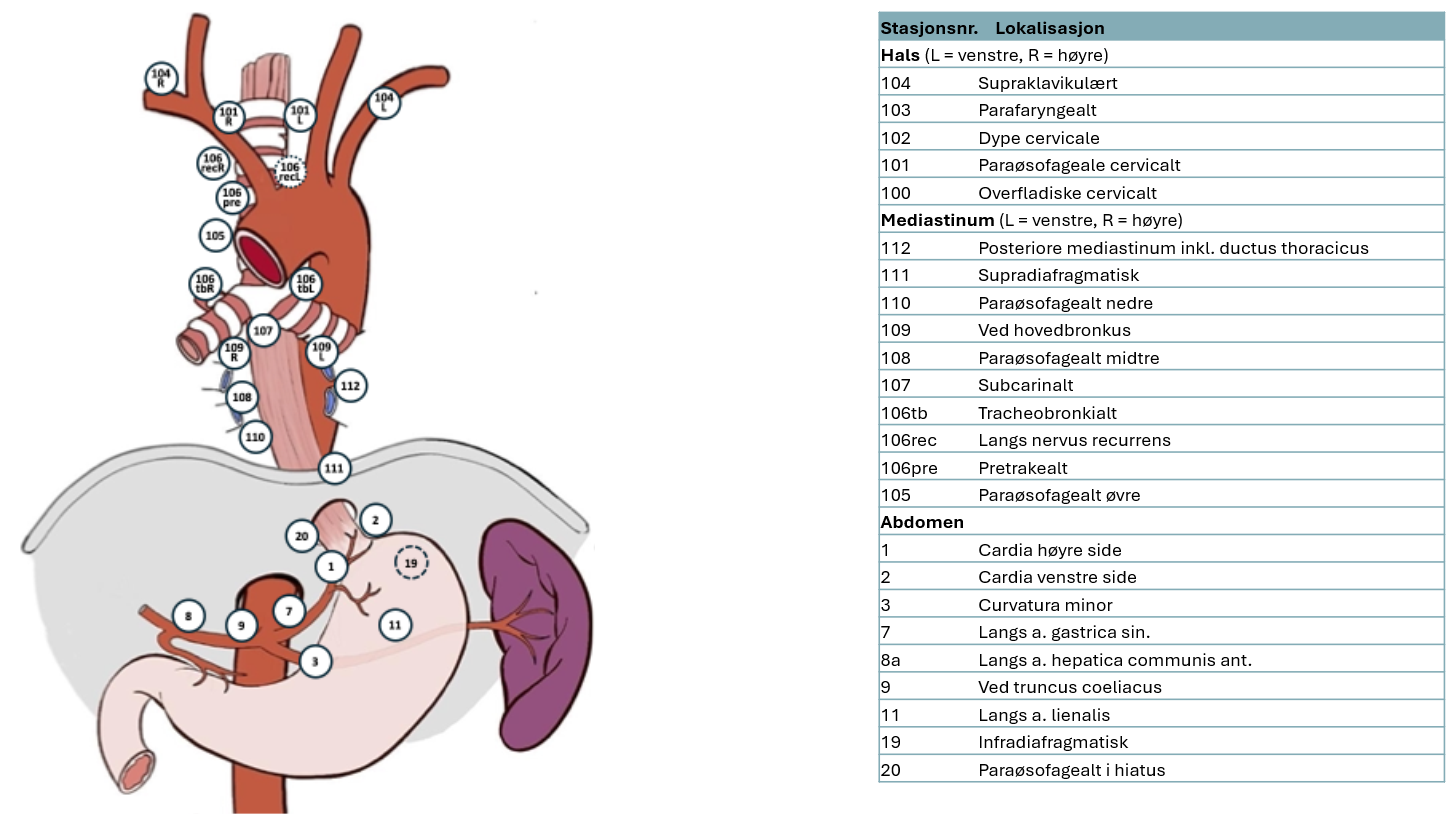
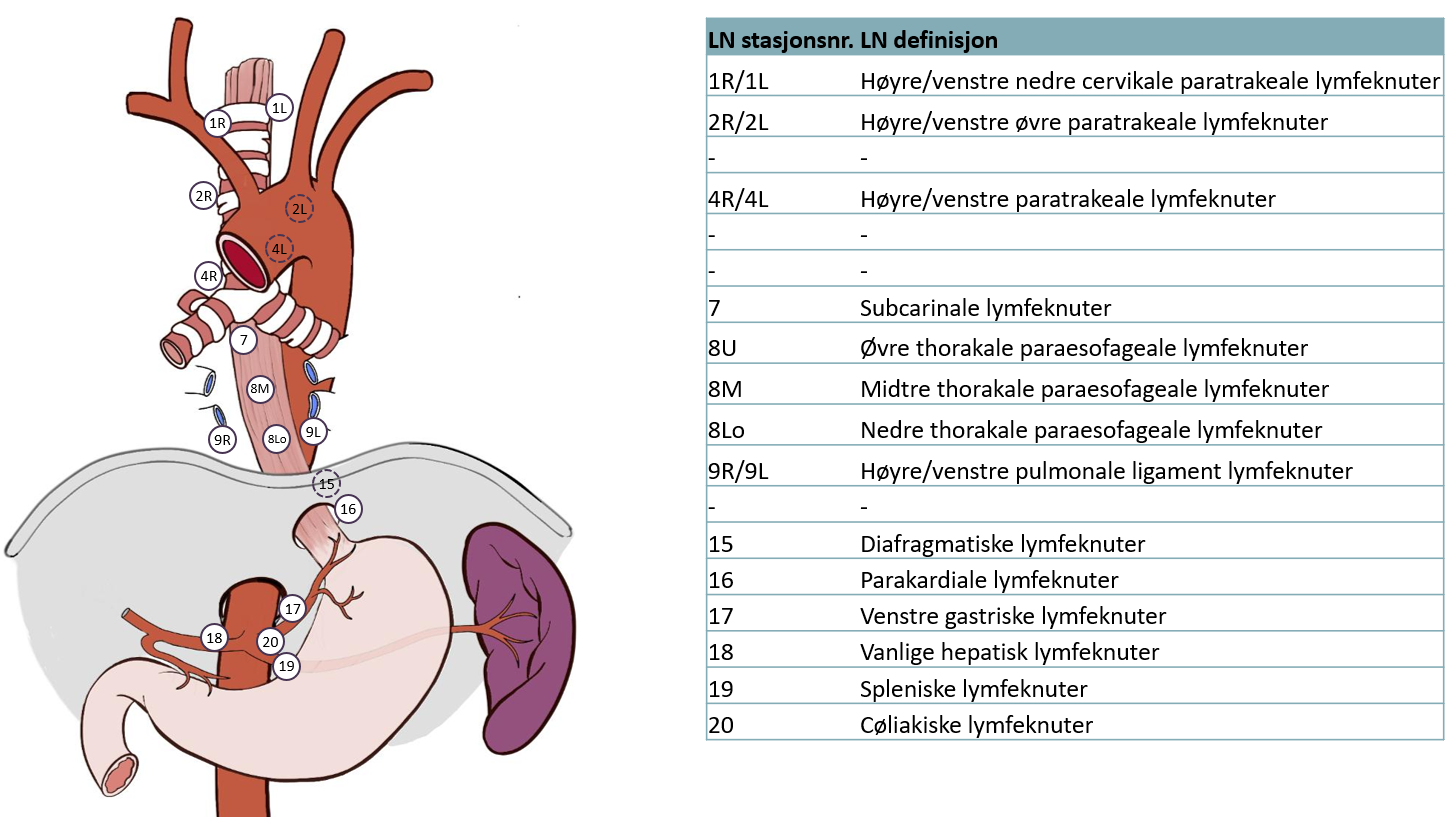
| Standard 2-felts | Utvidet 2-felts | Total 2-felts | 3-felts |
|---|---|---|---|---|
Abdomen | 1,2,3,7,8a,9,11p,20 | Som standard | Som standard | Som standard 2-felts |
Mediastinum | 107,108,109L/R, 110,111,112 | Som standard + 106tbR/L, 106recR 106pre,105 | Som utvidet +106recL,
| Som total 2-felts |
Hals |
|
|
| 101L/R |
Kreft i magesekk
Anbefalinger
- Operable pasienter med resektable svulster > T1bN0M0 bør tilbyes kirurgi etter vurdering av neoadjuvant kjemoterapi
- Svulster med episenter 2 cm distalt for gastroøsofageal overgangen (Siewert type III) bør behandles som magesekkreft med total gastrektomi
- Pasienter med risiko for eller mistanke om karsinomatose bør vurderes for diagnostisk laparoskopi før start av kurativt behandlingsløp
- Proksimale reseksjonsmargin bør være 5 cm. Ved T4 svulster bør det være 6 cm
- Ved øsofagus nære svulster hvor det gjøres total gastrektomi bør det utføres frysesnitt
- Det bør gjøres modifisert D2 lymfadenektomi
Kirurgisk reseksjon av kreft i magesekken utføres med få unntak i kurativ hensikt. Operasjonen utføres ved åpen kirurgi eller laparoskopi (eventuelt robotassistert). Laparoskopisk tilgang bør etterstrebes, men åpen tilgang er aktuelt blant annet ved multivisceral reseksjon, utvidet reseksjon av distale øsofagus eller affeksjon av bulbus duodeni. Behandlingen er sentralisert til regionale universitetssykehus. Se eget avsnitt for behandling av tidlig cancer uten organreseksjon (Ajani et al., 2022).
Tis | N0 | M0 | Endoskopisk behandling |
T1 | N0 | M0 | T1aN0: endoskopisk behandling T1bN0: kirurgisk eller endoskopisk reseksjon uten onkologisk behandling |
T2-T4a | N0, N1-N3 | M0 | Kirurgisk behandling med onkologisk behandling |
T4b | N0, N1-3 | M0 | Palliativ behandling eller definitiv radiokjemoterapi |
T1-4 | N0-3 | M1 | Palliativ onkologisk behandling ev. behandling med kurativ intensjon hos selekterte pasienter innenfor rammen av en studieprotokoll |
Egenprodusert basert på svensk retningslinje.
Operasjonsmetode for kreft i magesekk
Pasienter med risiko for karsinomatose bør vurderes for diagnostisk laparoskopi før start av kurativt behandlingsløp. Risiko for karsinomatose øker ved svulster større enn 8 cm, linitis plastica, bulkete eller grensestore para-aortale lymfeknuter påvist ved CT, eller ved T4 og utvalgte T3 svulster. Diagnostisk laparoskopi anbefales også ved usikkerhet om karsinomatose. Prosedyren bør gjøres ved regionale senter som har behandlingsansvar. Ved laparoskopien kan bursa omentalis åpnes og ventrikkelens bakside inspiseres hvis tumor sitter på ventrikkelens bakre vegg (Liu et al., 2019; Schena et al., 2023). Det bør utføres lavage for cytologi. Ved ascites bør det taes prøve av dette, før lavage. Ved positiv cytologi bør pasienten diskuteres på ny MDT.
Neoadjuvant onkologisk behandling anbefales til de fleste pasientene (se eget avsnitt), med kirurgi 4-6 uker etter avsluttet behandling. Pasienter med komorbiditet eller høy alder går oftest direkte til kirurgi. Kirurgi direkte kan også vurderes ved mikrosatelitt instabile svulster.
For svulster i proksimale del av magesekken (Siewert type III) gjøres total gastrektomi og øsofagojejunostomi (Ajani et al., 2022). Det samme kan være aktuelt ved Siewert type II selv om disse svulstene primært behandles med øsofagusreseksjon (Songun et al., 2010). Ved utvidet gastrektomi bør lymfeknute stasjonene 110, 111 og 112 taes med. Det bør utføres frysesnitt av reseksjonsrand mot spiserøret, ettersom mer enn 10 % av opererte pasienter kan ha ufri reseksjonskant ved kun makroskopisk vurdering av reseksjonskant (Hallissey et al., 1993).
Ved kreft i corpus eller antrum utføres ved intestinal svulsttype subtotal gastrektomi eller ventrikkel reseksjon gitt at man får tilfredsstillende frie render. Ved diffus type gjøres total gastrektomi eller man sikrer fri reseksjonskant med frysesnitt. Proksimal reseksjonsmargin på 5 cm fra tumors palpable avgrensning anses tilstrekkelig for intestinal og diffus tumortype (Lordick et al., 2022). Svulster som har penetrert serosa (T4a) kan kreve større reseksjonsmargin, og en margin på 6 cm fra tumors proksimale avgrensning for begge typer er anbefalt i disse tilfellene (Bozzetti et al., 1982).
Ved innvekst i naboorganer vurderes reseksjon enbloc når operasjonen kan utføres kurativt. Splenektomi utføres ikke rutinemessig, men vurderes ved proksimal tumor og lokalisasjon mot magesekkens major side, eller ved mistanke om metastatiske lymfeknuter i milthilus eller tumorinnvekst i milten. Det er ingen evidens for at omentektomi eller bursektomi gir overlevelsesgevinst (Kurokawa et al., 2018). Japanske retningslinjer anbefaler at man deler det gastrokoliske ligament minimum tre cm fra gastroepiploika karene, for å få med lymfeknutene svarende til stasjon 4 (Japanese Gastric Cancer Association, 2023).
I Europa og Vesten har det vært praksis ikke å ta med miltnære lymfeknuter (stasjon 10) ved lymfeknutedisseksjonen, med mindre det er indikasjon for splenektomi på grunn av innvekst av tumor. Det anbefales derfor at pasienter som får utført kurativ operasjon for kreft i magesekken opereres med D2 lymfeknutedisseksjon (minus stasjon 10) uten rutinemessig fjerning av milt eller distal pankreasreseksjon (Songun et al., 2010).
Antall lymfeknuter som undersøkes er av betydning for pålitelig stadie inndeling. Det er en assosiasjon mellom antall undersøkte lymfeknuter og langtidsoverlevelse. Det bør derfor undersøkes minst 16 lymfeknuter i preparatet (Coburn et al., 2018).
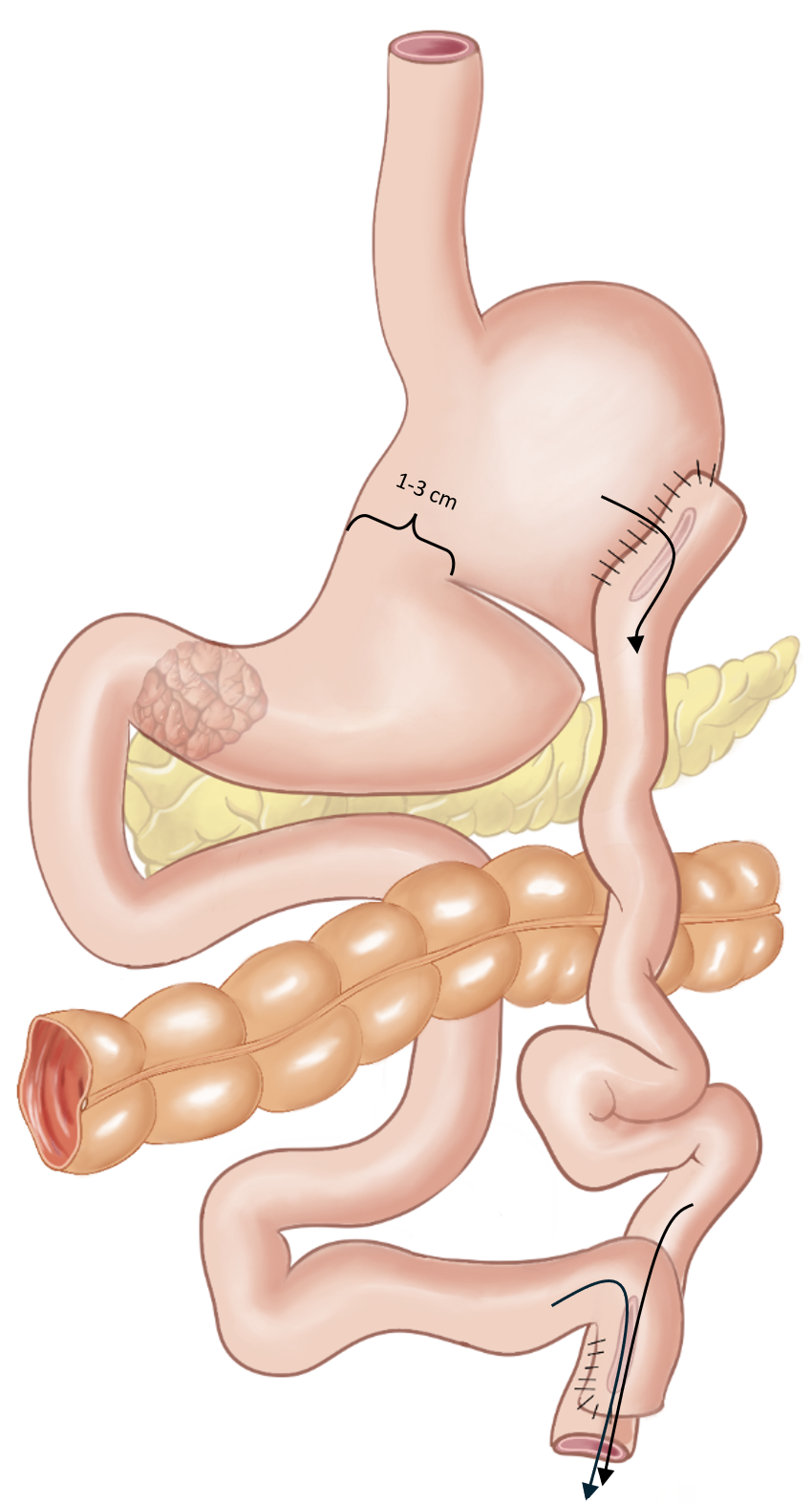
Total gastrektomi
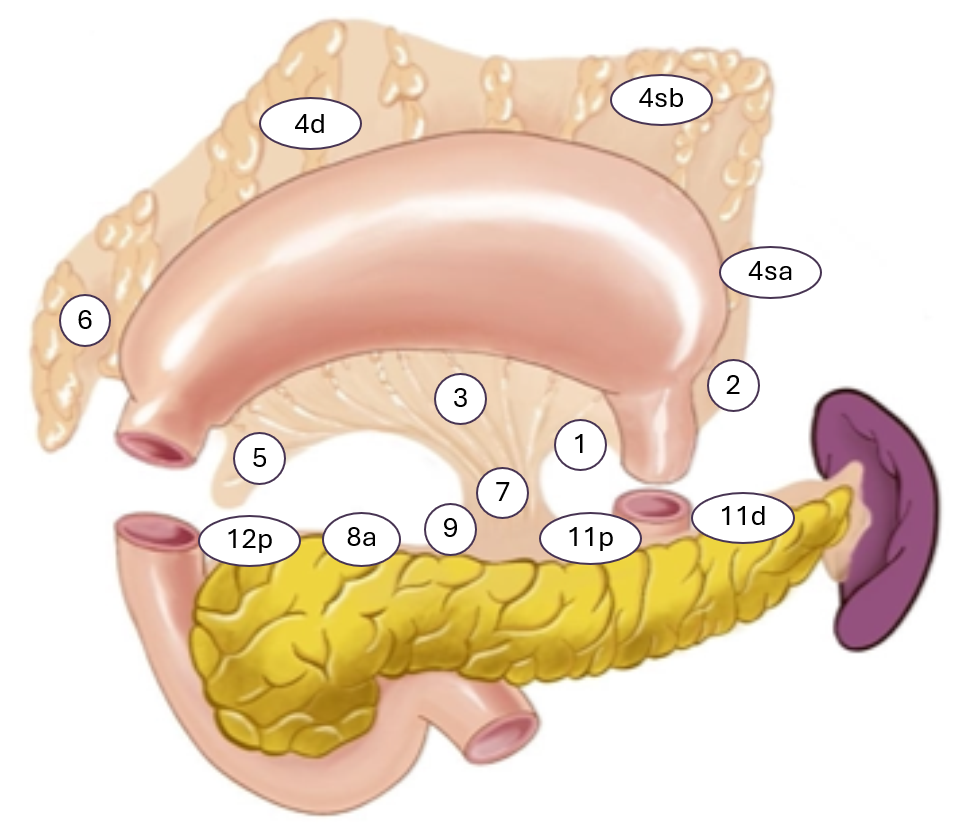
Det anbefales modifisert D2 lymfadenektomi (inkluderer stasjon 1-7. 8a, 9, 11p, 11d og 12a. Dersom tumor involverer major siden er det indikasjon for eksisjon av lymfeknute stasjon 10 (milt hilus) med eller uten splenektomi.
Ved total gastrektomi anbefales Roux-en-Y øsofagojejunostomi rekonstruksjon. Det er ikke vist noen fordeler om alimentære løp legges antekolisk eller retroskolisk. Enteroenterostomien bør legges 60 cm distalt for øsofagojejunostomien for å unngå refluks plager.
Ventrikkel reseksjon / subtotal gastrektomi
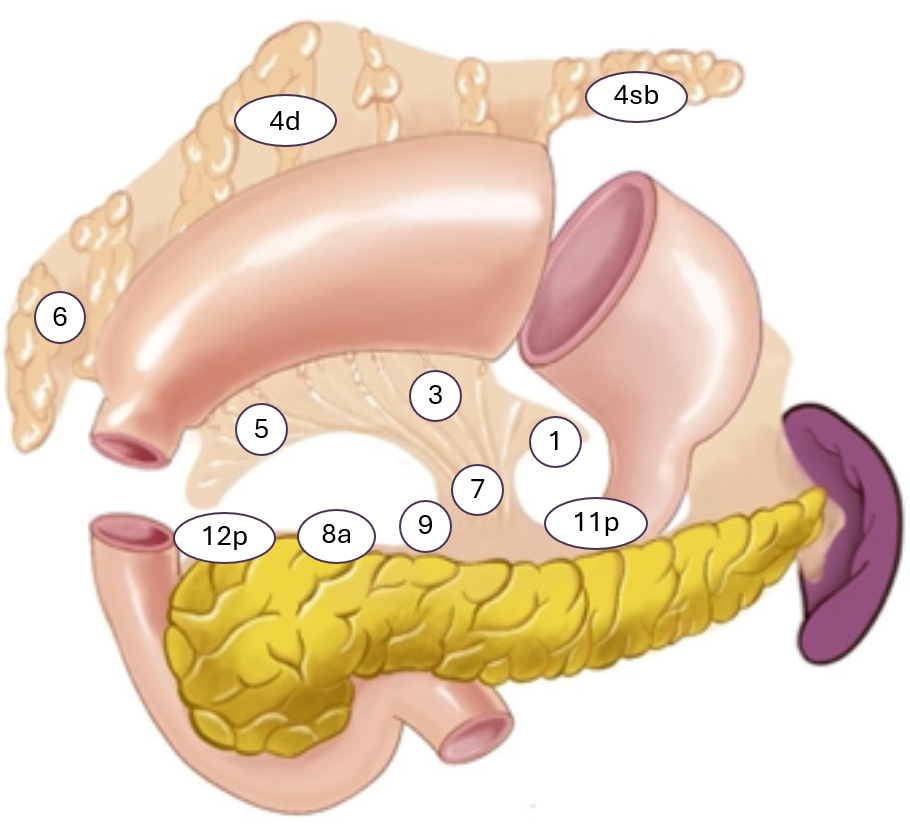
Ventrikkel reseksjon eller subtotal gastrektomi er aktuelt ved svulster i distale ventrikkel. Det bør være minimum 5 cm fri proksimal margin (Lordick et al., 2022). Ved T4a anbefales det 6 cm (Bozzetti et al., 1982). Det kan være aktuelt med frysesnittvurdering av proksimale reseksjonsrand. Ved ventrikkel reseksjon/ subtotal gastrektomi deles ventrikkel i proksimale corpus ventrikuli og det rekonstrueres med en Roux-en-Y gastrojejunostomi. Følgende lymfeknutestasjoner eksideres: 1, 3, 4sb, 4sd, 5, 6, 7, 8, 9, 11p og 12a. Eksisjon av lymfeknutestasjon 10 vurderes når kreftsvulsten sitter i proksimale ventrikkel, på majorsiden, og subtotal gastrektomi er da ikke aktuelt. Figuren nedenfor illustrerer de aktuelle lymfeknutestasjoner.
Ved øyeblikkelig reoperasjoner hos pasienter som har fått utført øsofagektomi eller gastrektomi, hvor årsaken kan relateres til primær operasjonen bør behandlingsansvarlig regionssykehus kontaktes før operasjonen.
Kirurgi ved palliative inngrep
I utvalgte tilfeller med residiverende transfusjonstrengende blødninger kan ventrikkel reseksjon eller gastrektomi vurderes. Ved obstruksjon hvor forholdene ikke ligger til rette for stent behandling kan gastroenterostomi enten anlagt endoskopisk eller laparoskopisk vurderes. Ved laparoskopi kan det gjøres «devine» gastroenterostomi med Roux-en-Y rekonstruksjon (Kumagai et al., 2016).