Målet med systemisk behandling av metastatisk/avansert brystkreftsykdom er å hindre sykdomsprogresjon/redusere sykdomsutbredelsen, å lindre symptomer, og å forlenge overlevelsen.
Ved potensielt endokrin følsom metastatisk sykdom, vil det primært være grunnlag for å velge endokrin behandling fremfor cytostatika. Selv om cytostatika sammenlignet med kun endokrin behandling gir en noe høyere responsrate, er det ingen overlevelsesgevinst ved å benytte dette først. I tillegg gir endokrin behandling mindre bivirkninger (Wilcken et al., 2003). Endokrin behandling som monoterapi ved hormonsensitiv brystkreft kan benyttes uavhengig av tilstedeværelse av viscerale metastaser, med unntak av pasienter med omfattende og raskt progredierende viscerale metastaser (visceral crisis). I sistnevnte tilfelle har det inntil nylig vært anbefalt cytostatika innledningsvis. Men resultatene fra Right Choice studien hvor endokrin behandling gitt i kombinasjon med CDK4/6 hemmeren ribociclib (CDK4/6 hemmere er omtalt i detalj senere i avsnittet) ble sammenlignet med kjemoterapi, viste at endokrin behandling/ribociclib ga bedre progresjonsfri overlevelse enn kjemoterapi ved «visceral crisis» (22 mnd vs 13 mnd) (Lu et al., 2024). Derfor kan CDK4/6 hemmer i kombinasjon med endokrin behandling vurderes som et (bedre) alternativ til kjemoterapi ved mer omfattende visceral sykdom etter vurdering av tumorkarakteristika og sannsynlig endokrin sensitivitet.
Det avgjørende kriterium for å velge endokrin behandling er derfor:
- Tumor er ER positiv
Tidligere var antiøstrogenet tamoxifen førstevalget i behandlingen av reseptor positiv metastatisk sykdom pga. medikamentets effektivitet og lave toksisitet. Etter introduksjonen av spesifikke aromatasehemmere, ble dette bildet endret. Aromatasehemmere (non-steroidale eller steroidale) ble et førstevalg hos postmenopausale kvinner enten de har brukt tamoxifen adjuvant eller ikke (Gibson et al., 2009). Av nyere medikamenter har anti-østrogenet fulvestrant vist effekter ved metastatisk brystkreft, også etter bruk av aromatasehemmer (Flemming et al., 2009). I tillegg viser flere studier at fulvestrant kan være et sammenlignbart alternativ til aromatasehemmer (Lønning et al., 2013; Robertson et al., 2016). Megestrol acetat ble benyttet regelmessig etter progresjon på tamoxifen før aromatasehemmerne ble introdusert (Parazzini et al., 1993). I dag vil dette medikamentet i noen tilfeller kunne ha en plass etter behandling med de overnevnte medikamenter. Det er flere studier som viser effekt av å benytte steroidal aromatasehemmer (exemestane) etter non-steroidal (letrozole, anastrozole) mens det er mindre dokumentasjon for bruk av non-steroidal etter steroidal (Beresford et al., 2011). I tillegg finnes det studier som viser effekter av østrogenterapi (Ellis et al., 2009; Lønning et al., 2001).
Everolimus i kombinasjon med exemestane eller tamoxifen, etter tidligere bruk av aromatasehemmer (for exemestane, etter non-steroidal aromatasehemmer), har vist betydelig effekt på progresjonsfri overlevelse (Bachelot et al., 2012; Baselga et al., 2012a). Bolero-2 studien (fase 3) viste 7 mnd økning i progresjonsfri overlevelse (HR 0.36; 95 % CI 0.28–0.45), men totaloverlevelsen ble ikke forbedret av denne behandlingen (Piccart et al., 2014). Tamrad studien (fase 2) viste 4.5 mnd økning i progresjonsfri overlevelse (HR 0.54; 95 % CI 0.36–0.81), og også bedring i totaloverlevelse (HR 0.45; 95 % CI 0.24–0.81). Det er også rapportert økt progresjonsfri overlevelse med everolimus i kombinasjon med fulvestrant sammenlignet med fulvestrant alene (Schmid et al., 2019). Resultatene viser at endokrin behandling kombinert med everolimus kan gi betydelige effekter ved progresjon/tilbakefall etter bruk av aromatasehemmer.
Everolimus i kombinasjon med eksemestan er derfor et behandlingsvalg etter progresjon på letrozol/anastrozol, vanligvis i 2. eller 3. linje. Everolimus i kombinasjon med tamoxifen eller fulvestrant kan være et alternativ, dersom eksemestan tidligere er benyttet.
Det foreligger nå resultater fra mange studier som har testet CDK4/6 hemmere (palbociclib, ribociclib og abemaciclib) i kombinasjon med endokrin behandling (se følgende referanser: ADDIN EN.CITE.DATA ADDIN EN.CITE.DATA (Cristofanilli et al., 2016; Dickler et al., 2017; Finn et al., 2015; Finn et al., 2014; Finn et al., 2016; Goetz et al., 2017; Hortobagyi et al., 2016; Hortobagyi et al., 2018; Loibl et al., 2017; O'Shaughnessy et al., 2018; Rugo et al., 2019; Slamon et al., 2018; Sledge et al., 2017; Tripathy et al., 2018; Turner et al., 2015; Turner et al., 2018)). Oppsummert viser studiene betydelig bedring i progresjonsfri overlevelse (PFS) ved kombinasjon av CDK4/6 hemmer og aromatasehemmer eller fulvestrant i 1. linje metastatisk situasjon (cirka 10 mnd bedring i progresjonsfri overlevelse).
Etter progresjon på aromatasehemmer har CDK4/6 hemmerne i kombinasjon med fulvestrant også vist tydelig effekt på progresjonsfri overlevelse (5–8 mnd bedring) (Slamon et al., 2020). I både 1. og 2. linje er det i flere studier også rapportert bedring i totaloverlevelse (cirka 10 mnd). Det er i løpet av de siste par år kommet ytterligere oppdateringer fra flere av studiene i tillegg til metaanalyser, som bekrefter tydelige effekter på totaloverlevelse både i kombinasjon med aromatasehemmer og i kombinasjon med fulvestrant (for eksempel Monaleesa-2: ribociclib+letrozol, 12.5 mnd, Monaleesa-3: ribociclib+fulvestrant 14.4 mnd) (Gao et al., 2021b; Hortobagyi et al., 2022; Im et al., 2019; Schettini et al., 2020; Slamon et al., 2020; Sledge et al., 2020).
På ESMO 2022 ble det også presentert data fra MONARCH3 studien (interimanalyse) som viste en tilsvarende 12.6 mnd forskjell i median totaloverlevelse ved bruk av abemaciclib+AI, men i hht statistisk plan foreløpig ikke signifikant (p=0.0392). Paloma-2/1 (palbociclib+letrozol) fant ikke signifikant overlevelsesforskjell for hele populasjonen, kun for pasientene med residivfritt intervall på > 12 mnd (ikke prespesifisert analyse) (Finn et al., 2022). Ut i fra responsrater og resultater på progresjonsfri overlevelse er det ingen sikre forskjeller mellom abemaciclib, ribociclib og palbociclib, ADDIN EN.CITE.DATA ADDIN EN.CITE.DATA (Cristofanilli et al., 2016; Dickler et al., 2017; Finn et al., 2015; Finn et al., 2014; Finn et al., 2016; Goetz et al., 2017; Hortobagyi et al., 2016; Hortobagyi et al., 2018; Loibl et al., 2017; O'Shaughnessy et al., 2018; Rugo et al., 2019; Slamon et al., 2018; Sledge et al., 2017; Tripathy et al., 2018; Turner et al., 2015; Turner et al., 2018). Men for totaloverlevelse viser de foreliggende hovedresultater at ribociclib gir klart bedret totaloverlevelse, foreløpige data for abemaciclib med begrenset observasjonstid antyder samsvarende overlevelseseffekt som for ribociclib, mens det ikke er vist forbedring av totaloverlevelse for palbociclib.
De ikke helt samsvarende resultatene for PFS og OS for de tre CDK4/6 hemmerne kan ha flere årsaker, inkludert forskjeller i studiedesign, studiepopulasjon eller potensielle reelle effektforskjeller. Det foreligger foreløpig ikke «head to head» sammenligninger mellom de forskjellige CDk4/6 hemmerne. Men totaloverlevelsesresultatene nevnt over taler for valg av ribociclib eller abemaciclib fremfor palbociclib. Bivirkningsmessig er det klare forskjeller mellom abemaciclib på ene siden og ribociclib/palbociclib på andre siden når det gjelder bivirkninger. Mens ribociclib/palbociclib gir en høyere forekomst av nøytropeni/beinmargsdepresjon, gir abemaciclib en høyere forekomst av diaré.
Bruk av CDK4/6 hemmer bør benyttes i kombinasjon med aromatasehemmer (eller eventuelt fulvestrant) i 1. linje eller i kombinasjon med fulvestrant i 2. linje (etter progresjon på aromatasehemmer alene). Som oftest anbefales at CDK4/6 hemmer introduseres i 1. linje, heller enn å vente til 2. linje. Dette støttes også av MONALEESA-3-studien som viste en større gevinst i totaloverlevelse for dem som fikk behandling med ribociclib i 1. linje enn dem som fikk det i 2. linje. Det foreligger nå resultater fra en sekvensiell studie, som kan bidra til ytterligere veiledning vedrørende dette spørsmålet. SONIA studien ble presentert på ASCO2023.
Studien randomiserte mellom bruk av AI i første linje +/- CDK4/6 hemmer etterfulgt av fulvestrant ved progresjon +/- CDK4/6 hemmer, hvor pasienter som mottok CDK4/6 hemmer i 1. linje ikke mottok det i 2. linje, samt motsatt for pasienter som kun fikk AI i første linje. Studien viste betydelig forskjell i PFS i 1. linje, i tråd med de publikasjoner som er nevnt over, mens det ikke var forskjell i PFS etter 2. linje og heller ikke for totaloverlevelse (Sonke et al., 2023). Resultatene i studien endrer ikke på at CDK4/6 hemmer primært anbefales i 1. linje, men kan benyttes til støtte for å vente til 2. linje for pasienter som vurderes å være best tjent med en enklere behandling i første linje (ut fra alder/biologi/annet).
På generelt grunnlag vurderes tolerabiliteten av ribociclib/palbociclib å være bedre enn abemaciclib, valg av CDK4/6 hemmer bør avgjøres av tilgjengelighet og klinisk vurdering ut fra nytte/tolerabilitet. Dersom pasienten har problemer knyttet til beinmargsdepresjon, slik som repeterende nøytropene infeksjoner, transfusjonsbehov eller lignende kan abemaciclib være å foretrekke. Behandling med CDK4/6 hemmere er kun aktuell for kvinner med metastatisk brystkreft som er naturlig eller indusert postmenopausale. Det foreligger ikke nok data per idag til å konkludere på eventuell bruk av CDK4/6 hemmer «beyond progression», det vil si at man skifter til annen endokrin behandling ved progresjon, men beholder CDK4/6 hemmeren, selv om MAINTAIN studien presentert på ASCO2022 viste noe bedring i median progresjonsfri overlevelse ved å legge til ribociclib til ny endokrin behandling (2.5 mnd) (Kalinsky et al., 2022).
Det er også publisert resultater fra 2 studier der man har sammenlignet cellegift og kombinert endokrin terapi + CDK4/6 hemmer hos pasienter med hormonreseptor positiv, HER2 negativ brystkreft. I Young-PEARL studien fikk premenopausale kvinner med metastatisk brystkreft palbociclib + exemestane (sammen med LHRH analog) her fant man bedre progresjonsfri overlevelse og mindre bivirkninger enn med capecitabine (Park et al., 2019). En sammenligning av ribocliclib kombinert med letrozol mot kjemoterapi hos postmenopausale kvinner hos luminal-B pasienter i stadium I-IIIA (CORALLEEN-studien) ble også nylig publisert av Prat et al. (Prat et al., 2020).
Spesielle forholdsregler ved bruk av ribociclib: Behandling med ribociclib skal kun initieres ved QTcF <450 millisekunder. Bruk bør unngås ved eksisterende eller signifikant risiko for utvikling av QTC-forlengelse. Samtidig bruk av legemidler som gir QTC-forlengelse og/eller er sterke CYP3A4-hemmere bør unngås (Kisqali, 2020). Det henvises til felleskatalogtekst vedrørende EKG monitorering og overvåking av leverprøver i starten av behandlingen med ribociclib.
Den prospektive, randomisert kliniske studien S0226 inkluderte postmenopausale kvinner med HR+, HER2- metastatisk brystkreft (MBC) til førstelinjes behandling med anastrozole +/– fulvestrant 250 mg månedlig. Studien viste forlenget progresjonsfri overlevelse for pasienter som mottok kombinasjonen av anastrozol og fulvestrant som ikke hadde benyttet endokrin behandling i adjuvant situasjon (Mehta et al., 2019). Resultatene fra denne studien endrer ikke retningslinjer som anbefaler aromatasehemmer (AI) + CDK4/6 hemmer i første linje (evt andre linje) ved HR+, HER2- MBC. Kombinasjonen av AI + CDK4/6 hemmer gir PFS på 25 mndr. med bruk av ribociclib og palbociclib i hhv. MONALEESA-2 og PALOMA-2 studiene (Finn et al., 2016; Hortobagyi et al., 2016). Dessuten var dosen av fulvestrant på 250 mg månedlig i S0226 for lav i.f.t. dagens anbefalinger (500 mg) – det kan derfor være at tilleggseffekten av AI sammen med fulvestrant er lavere når fulvestrant gis i adekvat dose på 500 mg månedlig. Man har heller ikke i S0226 studien sammenlignet fulvestrant + anastrozole kombinasjon mot sekvensiell fulvestrant etterfulgt av anastrozole.
Kombinasjonen av AI + fulvestrant kan vurderes der CDK4/6 hemmer ikke er aktuelt og spesielt hos pasienter som er behandlingsnaive m.t.p. endokrin terapi.
Mange pasienter kan ha nytte av flere behandlingslinjer. Hvordan behandlingsforløpet for den enkelte pasient vil bli, avhenger både av effekt av den enkelte behandling, toksisitet og pasientens allmenntilstand. Det er ingen internasjonal konsensus for hvilken medikamentrekkefølge som bør benyttes. Onkolog bør ha ansvar for all sekvensiell endokrinbehandling ved avansert brystkreftsykdom.
Alpelisib for PIK3CA muterte HR+HER2-.
SOLAR-1 studien som ble publisert i 2019 viste overlevelsesgevinst (PFS) for alpelisib + fulvestrant vs. fulvestrant alene hos HR+/HER2- pasienter med metastaser med PIK3CA mutasjon i tumor etter progresjon på én linje endokrin terapi (hovedsaklig aromatasehemmer alene) (Andre et al., 2019a). Oppdaterte data for totaloverlevelse er også publisert (André et al., 2021). Det var ingen signifikant bedre totaloverlevelse med tillegg av alpelisib (prespesifisert effektgrense satt til p≤0.0161), men numerisk var OS klart forbedret med 39 vs. 31 mnd for pasienter med PIK3CA mutert sykdom. Samtidig viser BYLIEVE studien en responsrate på 20% og clinical benefit rate (respons eller stabil sykdom) på 42% med alpelisib + «endokrin terapi B» etter progresjon på CDK4/6 hemmer og «endokrin terapi A», og der 50% var uten sykdomsprogresjon etter 6 mnd behandling med alpelisib + endokrin terapi (Rugo et al., 2020). Turner et al fant også at alpelisib i kombinasjon med fulvestrant etter CDK4/6 hemmer i BYLIEVE studien var bedre enn real world data for fulvestrant i samme situasjon (ikke randomisert) (Turner et al., 2021). Det anbefalesbruk av Alpelisib etter progresjon på endokrin behandling (sammen med CDK4/6 hemmer), dersom tumor er PIK3CA mutert. Alpelisib er godkjent i Nye metoder. Alpelisib gir høy risiko for hyperglykemi. En ny «real world» studie viser betydelig økt risiko i forhold til hva som ble rapportert i studiene (40% grad 3-4 hyperglykemi) (Biganzoli et al., 2021). Det bør tas HBA1c før oppstart av behandlingen og oppstart og oppfølging gjøres i dialog med endokrinolog/etter plan anbefalt av endokrinolog.
Følgende medikamentgrupper er tilgjengelige og anses å kunne ha en plass som ledd i medikamentell endokrin behandling:
- Antiøstrogener (fulvestrant, tamoxifen)
- Aromatasehemmere (anatrozole, exemestane, letrozole)
- CDK4/6 hemmer i kombinasjon med aromatasehemmer eller fulvestrant
- Everolimus i kombinasjon med exemestane (kan også kombineres med tamoxifen eller fulvestrant)
- Alpelisib i kombinasjon med endokrin behandling
- Gestagener (megestrol acetat)
- Østrogener (omtales ikke i den nedenstående anbefaling, da det gjelder enkeltpasienter og krever spesialkompetanse)
Nye og lovende medikamenter i kombinasjon med endokrin behandling.
Det er i de senere år utviklet nye orale selektive estrogen reseptor «degradatorer» (SERD). Det er rapportert meget gode resultater for enkelte av disse, og det forventes ytterligere resultater for flere andre de nærmeste år. Foreløpig omtales kun elacestrant: Resultatene fra EMERALD studien viser at elacestrant gir bedre progresjonsfri overlevelse enn fulvestrant etter AI+CDK4/6 hemmer (HR 0.70; 95% CI, 0.55 to 0.88; P =0.002) både for alle inkluderte pasienter og for ESR1 ctDNA muterte pasienter (HR 0.55) (Bidard et al., 2022). Interim resultater for totaloverlevelse viser HR på 0.59 i ESR1 mutert populasjon (i ikke mutert populasjon HR 0.92) og HR 0.75 i hele populasjonen. OS resultatene er ikke signifikante på dette tidspunktet og de endelige resultatene må avventes før endelig konklusjon. Subgruppeanalyser viser spesielt gode resultater hos ESR1 muterte pasienter som tidligere har vært behandlet med CDK4/6 hemmer i >12 mnd (median bedring i PFS på >6 md) (Bardia et al., 2024a). Medikamentet er således av fremtidig viktig betydning for denne undergruppe av HR+HER2- pasienter. Elacestrant er EMA godkjent (har fått markedsføringstillatelse, MT). Medikamentet er besluttet metodevurdert i Nye Metoder. Per januar 2025 venter DMP fortsatt på dokumentasjon fra legemiddelfitma, og metodevurderingen er ennå ikke påbegynt. Vi vet ikke hvordan effekten av elacestrant vil være sammenlignet med fulvestrant + alpelisib for pasienter med PIK3CA mutert sykdom.
Capivasertib er en AKT hemmer som nylig har vist meget gode resultater i kombinasjon med fulvestrant, - sammenlignet med fulvestrant alene (Capitello-291) (Turner et al., 2023). Cirka 70% av pasientene hadde fått CDK4/6 hemmer i kombinasjon med endokrin behandling tidligere. Resultatene viste 4.2 mnd bedring i median progresjonsfri overlevelse for pasienter med endringer i PIK3CA, PTEN, eller AKT signalveiene. Det er signifikant forskjell i totaloverlevelse for hele den inkluderte populasjonen. Effekten var uavhengig av tidligere bruk av CDK4/6 hemmer. Medikamentet vurderes til å være av fremtidig viktig betydning for HR+HER2- pasienter med de nevnte signalveisendringer. Men medikamentet er foreløpig ikke sammenlignet med endokrin behandling + mTOR eller PI3K hemmer. Capivasertib er EMA godkjent (har fått MT). Medikamentet er under metodevurdering i Nye metoder.
ESMO og ASCO guidelines anbefaler mutasjonsanalyser (ESR1/PIK3CA/AKT/PTEN) av tumor/tumorceller som grunnlag for å velge mellom tilleggsmedikamentene elacestrant, capivasertib og alpelisib, til bruk sammen med endokrin behandling (Burstein et al., 2024; Curigliano et al.; Gennari et al., 2021). Foreløpig er kun alpelisib innført i Norge (nyemetoder.no), noe som p.t. gjør at PIK3CA mutasjonsanalyse er den som i dag gir behandlingsmessig konsekvens i våre sykehus.
Spesielle forhold for HER2 positive
TransATAC/BIG 1–98 gir holdepunkter for kortvarig/beskjeden effekt av endokrin behandling hos HER2 positive. Men så lenge sykdomsutviklingen tillater å avvente en endokrin respons, bør likevel endokrin behandling forsøkes. To studier (TAnDEM og EGF30008) viser effekt på progresjonsfri overlevelse ved å kombinere endokrin behandling med HER2 rettet behandling, sammenlignet med kun endokrin behandling (HR henholdsvis 0.63 og 0.71) (Johnston et al., 2009; Kaufman et al., 2009). Studiene mangler en arm med bare HER2 rettet behandling alene, noe som gir en viss usikkerhet i hva en oppnår med kombinasjonsbehandling. I tillegg har vi ikke data som sier noe om sekvensiell behandling versus kombinasjonsbehandling. Resultatene fra studien kan likevel understøtte bruk av HER2-rettet behandling i kombinasjon med endokrin behandling. Dette oppfattes som en behandlingsopsjon.
Endokrin behandling hos pre- og perimenopausale kvinner
Hvis man er usikker på menopausal status, mål FSH og LH og østradiol (med høy-sensitivt assay).
1. linje
LHRH analog (for eksempel goserelin (Zoladex®) 3.6 mg s.c. hver 4. uke). Hvis man observerer effekt, skal LHRH-analog vurderes erstattet med ovarialbestråling eller oophorectomi.
Det bør vurderes å legge til behandling som for førstelinje ved postmenopausal status, og alltid hvis østrogen-nivået anses å ha falt i god tid før metastaser oppstod.
2. linje og videre som for postmenopausale (fra 1. linje) (se nedenfor)
Endokrin behandling hos postmenopausale kvinner. Se oversikten under.
Spesielle forhold for HER2 positive
TransATAC/BIG 1–98 gir holdepunkter for kortvarig/beskjeden effekt av endokrin behandling hos HER2 positive. Men så lenge sykdomsutviklingen tillater å avvente en endokrin respons, bør likevel endokrin behandling forsøkes. To studier (TAnDEM og EGF30008) viser effekt på progresjonsfri overlevelse ved å kombinere endokrin behandling med HER2 rettet behandling, sammenlignet med kun endokrin behandling (HR henholdsvis 0.63 og 0.71) (S. Johnston et al., 2009; B. Kaufman et al., 2009). Studiene mangler en arm med bare HER2 rettet behandling alene, noe som gir en viss usikkerhet i hva en oppnår med kombinasjonsbehandling. I tillegg har vi ikke data som sier noe om sekvensiell behandling versus kombinasjonsbehandling. Resultatene fra studien kan likevel understøtte bruk av HER2-rettet behandling i kombinasjon med endokrin behandling. Dette oppfattes som en behandlingsopsjon.
Alpelisib for PIK3CA muterte HR+HER2-
SOLAR-1 studien som ble publisert i 2019 viste overlevelsesgevinst (PFS) for alpelisib + fulvestrant vs. fulvestrant alene hos HR+/HER2- pasienter med metastaser med PIK3CA mutasjon i tumor etter progresjon på én linje endokrin terapi (hovedsaklig aromatasehemmer alene) (Andre et al., 2019a). Oppdaterte data for totaloverlevelse er også publisert (André et al., 2021). Det var ingen signifikant bedre totaloverlevelse med tillegg av alpelisib (prespesifisert effektgrense satt til p≤0.0161), men numerisk var OS klart forbedret med 39 vs. 31 mnd for pasienter med PIK3CA mutert sykdom. Samtidig viser BYLIEVE studien en responsrate på 20% og clinical benefit rate (respons eller stabil sykdom) på 42% med alpelisib + «endokrin terapi B» etter progresjon på CDK4/6 hemmer og «endokrin terapi A», og der 50% var uten sykdomsprogresjon etter 6 mnd behandling med alpelisib + endokrin terapi (Rugo et al., 2020). Turner et al fant også at alpelisib i kombinasjon med fulvestrant etter CDK4/6 hemmer i BYLIEVE studien var bedre enn real world data for fulvestrant i samme situasjon (ikke randomisert) (Turner et al., 2021). Det anbefalesbruk av Alpelisib etter progresjon på endokrin behandling (sammen med CDK4/6 hemmer), dersom tumor er PIK3CA mutert. Alpelisib er godkjent i Nye metoder. Alpelisib gir høy risiko for hyperglykemi. Det bør tas HBA1c før oppstart av behandlingen og oppstart og oppfølging gjøres i dialog med endokrinolog/etter plan anbefalt av endokrinolog.
Følgende medikamentgrupper anses å kunne ha en plass:
- Antiøstrogener (fulvestrant, tamoxifen)
- Aromatasehemmere (anatrozole, exemestane, letrozole)
- CDK4/6 hemmer i kombinasjon med aromatasehemmer eller fulvestrant
- Everolimus i kombinasjon med exemestane (kan også kombineres med tamoxifen eller fulvestrant)
- Alpelisib i kombinasjon med endokrin behandling
- Gestagener (megestrol acetat)
- Østrogener (omtales ikke i den nedenstående anbefaling, da det gjelder enkeltpasienter og krever spesialkompetanse)
Elacestrant. Resultatene fra EMERALD studien viser at elacestrant gir bedre progresjonsfri overlevelse enn fulvestrant etter AI+CDK4/6 hemmer (HR 0.70; 95% CI, 0.55 to 0.88; P =0.002) både for alle inkluderte pasienter og for ESR1 ctDNA muterte pasienter (HR 0.55) (Bidard et al., 2022). Interim resultater for totaloverlevelse viser HR på 0.59 i ESR1 mutert populasjon (i ikke mutert populasjon HR 0.92) og HR 0.75 i hele populasjonen. OS resultatene er ikke signifikante på dette tidspunktet og de endelige resultatene må avventes før endelig konklusjon. Resultatene ved bruk av elacestrant er gode og gir grunnlag for bruk av dette medikamentet etter godkjenning. Samtidig vet vi ikke hvordan effekten av elacestrant vil være sammenlignet med fulvestrant + alpelisib for pasienter med PIK3CA mutert sykdom. Medikamentet er under vurdering i EMA.
Anbefalt endokrin behandling av postmenopausale pasienter med metastaser
Ved premenopausal status anbefales LHRH agonist og videre behandling som for postmenopausale.
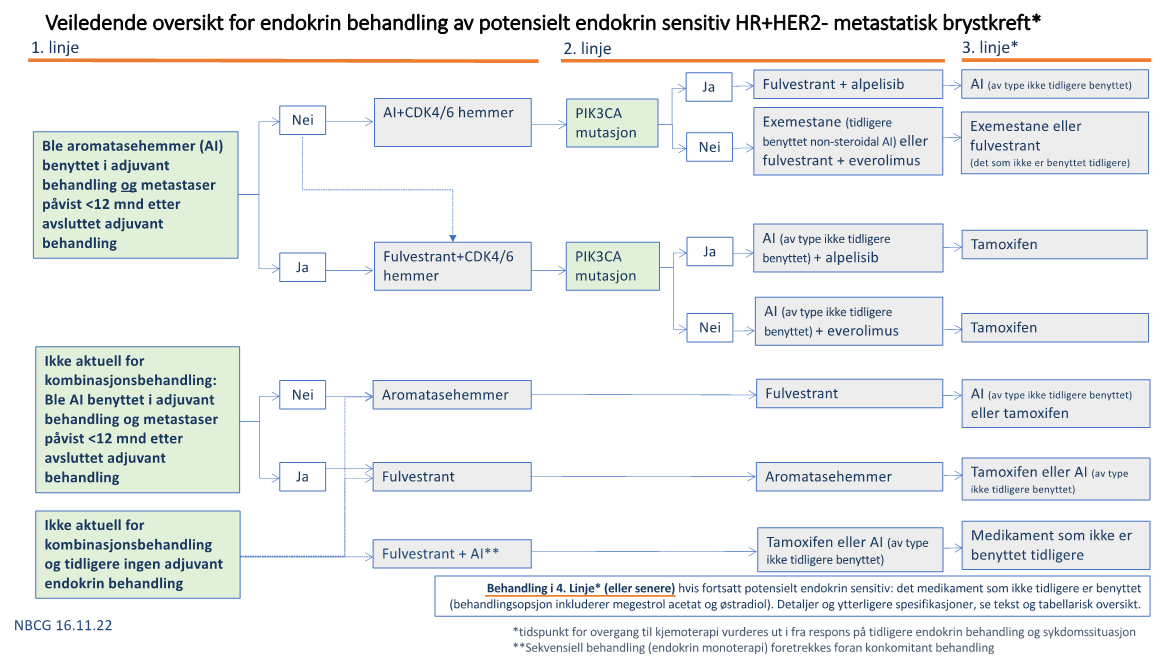
Under følger tabellarisk oversikt over behandlingsanbefalingene. I tillegg skisseres anbefalingene også i figuren under. Det er anført flere anbefalte behandlingsvalg i behandlingslinjene, da det ikke foreligger sikre data som tilsier at en spesiell behandlingsrekkfølge bør følges.
I noen tilfeller kan det være aktuelt å starte behandling i tråd med behandlingslinje 2+3 nedenfor.
Spesifikasjon | Medikament | Kommentar | |
|---|---|---|---|
Behandlings-linje 1 | Dersom aromatasehemmer (AI) ikke ble benyttet i adjuvant eller metastaser ble påvist >12 mnd etter avsluttet AI behandling | Aromatasehemmer + CDK4/6 hemmer Alternativt kan fulvestrant (500 mg) + CDK4/6 hemmer gis | Valg av CDK4/6 hemmer: de foreliggende resultater taler primært for valg av ribociclib eller abemaciclib fremfor palbocilib. Dersom det er langt sykdomsfritt intervall mellom adjuvant behandling og metastasesituasjon, begrenset sykdom og lavgradig biologi, eller eldre pasienter med behov for enkelt behandlingsopplegg, kan CDK4/6 hemmer avventes og heller benyttes i 2. linje Dersom påvisning av metastaser under adjuvant behandling og aromatasehemmer (AI) har vært benyttet adjuvant men ikke i de siste 24 mnd før metastasetidspunkt kan det vurderes å benytte AI i kombinasjon med CDK4/6 hemmer på individuelt grunnlag. |
Dersom AI ble benyttet i adjuvant situasjon med påvisning av metastaser under eller innen 12 mnd etter avsluttet adjuvant AI behandling | Fulvestrant (500 mg) + CDK4/6 hemmer | ||
Behandlingsnaive pasienter | Aromatasehemmer + CDK4/6 hemmer el. Fulvestrant (500 mg) + CDK4/6 hemmer | ||
Dersom det vurderes at CDK4/6 hemmer og alpelisib ikke er aktuell behandling i noen av behandlingslinjene og pas ikke har mottatt endokrin behandling tidligere | Aromatasehemmer, fulvestrant (500 mg) eller aromatasehemmer i kombinasjon med fulvestrant (250 mg) | Sekvensiell behandling (endokrin monoterapi) foretrekkes foran konkomitant behandling | |
Behandlings-linje 2+3 | Dersom PIK3CA mutasjon påvises og letrozol + CDK4/6 hemmer er benyttet tidligere | Fulvestrant (500 mg) + alpelisib¤ |
|
Dersom PIK3CA mutasjon påvises og fulvestrant (500 mg) + CDK4/6 hemmer er benyttet tidligere | Aromatasehemmer + alpelisib¤ | Pasienter ble behandlet med letrozol i kombinasjon med alpelisib i Cohort B i ByLieve studien – endelige resultater fra denne cohort er ikke publisert men median PFS synes å være sammenlignbar med undergruppe av pasienter som fikk fulvestrant+alpelisib etter tidligere AI (PMID: 35348782) | |
Dersom AI ble benyttet uten CDK4/6 hemmer i tidligere behandlingslinje | Fulvestrant (500 mg) + CDK4/6 hemmer | Bør gis som 2. linjes behandling | |
Dersom det ikke påvises PIK3CA mutasjon og fulvestrant (500 mg) + CDK4/6 hemmer er benyttet tidligere | Exemestan + everolimus |
| |
Dersom det ikke påvises PIK3CA mutasjon og letrozol + CDK4/6 hemmer er benyttet tidligere | Exemestan eller fulvestrant + everolimus | Tamoxifen kan benyttes som alternativ til fulvestrant, men som sekundært valg basert på effektestimater | |
Dersom morbiditet og/eller tolerabilitet ikke gjør kombinasjonsbehandling mulig, eller kombinasjonsbehandling ikke lenger er aktuelt | Aromatasehemmer, fulvestrant eller tamoxifen | Bruk det medikament som ikke tidligere er gitt. Dersom ikke-steroidal AI er benyttet tidligere, kan det skiftes til steroidal AI, eller motsatt. Effekten av fulvestrant oppfattes sammenlignbar med AI. Tamoxifen er et sekundært alternativ, og oppfattes å ha noe mindre effekt sammenlignet med AI | |
Behandlings-linje 4 og senere |
| Ett av de tidligere nevnte behandlingsvalg som ikke er benyttet | Vil være de primære valg |
| Megestrol Acetat | ||
| Østradiol | Hvis aktuelt, bør slik behandling styres av onkolog med spesialkompetanse i endokrin terapi |
# effektene av palbociclib, ribociclib og abemaciclib er sammenlignbare for PFS og oppfattes å være en klasseeffekt. Det foreligger forskjeller i rapportert effekt på totaloverlevelse mellom medikamentene, p.t. i favør av ribociclib og abemaciclib. Valg av medikament kan for øvrig vurderes ut ifra bivirkningsprofil og på individuelt grunnlag.
Vedrørende bruk av ribociclib: Behandling med ribociclib skal kun initieres ved QTcF <450 millisekunder. Bruk bør unngås ved eksisterende eller signifikant risiko for utvikling av QTc-forlengelse. Samtidig bruk av legemidler som gir QTc-forlengelse og/eller er sterke CYP3A4-hemmere bør unngås. Det henvises til felleskatalogtekst vedrørende EKG-monitorering og overvåking av leverprøver i starten av behandlingen.
Pasienter med BRCA1/2 mutert HR+ brystkreft som er endokrint behandlingsresistente/ikke er kandidater for endokrin behandling og hvor bruk av kjemoterapi ikke er ønskelig, kan vurderes for talazoparib (kfr "Spesielle forhold for BRCA muterte pasienter"). Dette er i tråd med oppdaterte ASCO guidelines (Burstein et al., 2021b)
¤Alpelisib gir høy risiko for hyperglykemi. Det bør tas HBA1c før oppstart av behandlingen og oppstart og oppfølging gjøres i dialog med endokrinolog/etter plan anbefalt av endokrinolog.
Kontinuert CDK4/6 behandling ved progresjon. Det foreligger nå resultater fra 4 randomiserte studier som har testet videre bruk av CDK4/6 hemmere med endret endokrin behandling (hovedsakelig fulvestrant) ved progresjon. I to av studiene har palbociclib blitt videreført i begge linjer (PACE:90% av pasientene; PALMIRA: 100% av pasientene) (Llombart-Cussac et al., 2023; Mayer et al., 2023). Studiene viste ingen effekt på PFS ved å fortsette med CDK4/6 hemmer etter progresjon i 1. linje. I MAINTAIN studien ble palbociclib benyttet i 1. linje (84% av pasientene) mens pasientene ble skiftet til ribociclib i 2. linje (Kalinsky et al., 2023). Studien viste en forskjell i PFS på 2.5 mnd i favør av ribociclibarmen (HR 0.57 95% CI 0.39-0.85). Men for alle studiene var median PFS i armene som benyttet CDK4/6 hemmer i 2. linje lav (5.3 mnd MAINTAIN; 4.6 mnd PACE; 4.9 mnd PALMIRA). Resultatene kan tyde på at ribociclib kan gi tilleggseffekter etter palbociclib i 1. linje for noen pasienter, mens kontinuert behandling med samme CDK4/6 hemmer ikke viser effekt. På ASCO 2024 ble det presentert resultater fra fase 3 studien postMONARCH, som testet abemaciclib i kombinasjon med fulvestrant versus fulestrant alene. Resultatene viste bedret PFS (HR 0.73 (0.57-0.95)) (Kalinsky et al., 2024). Subgruppeanalysene taler for at effekten primært er knyttet til pasienter som fikk palbociclib i første linje.
Kontinuert CDK4/6 behandling anbefales ikke på generelt grunnlag. Men for pasienter som progredierer på palbociclib i 1. linje og hvor annen type kombinasjonsbehandling er vanskeliggjort/mindre aktuelt kan kombinasjonsbehandling med ribociclib eller abemaciclib vurderes på individuelt grunnlag
Kilde: Norsk bryst cancer gruppe (2022b) Copyright NBCG 2022. Gjengitt med tillatelse.