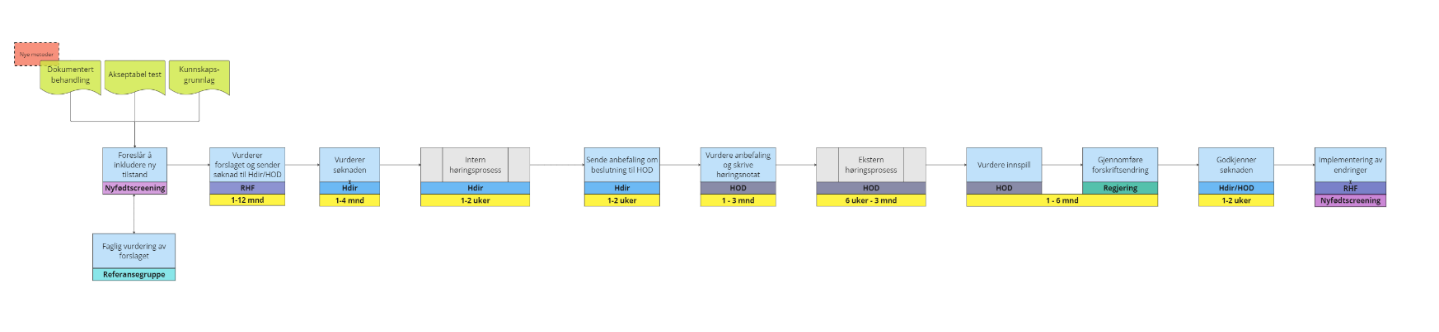
Det er den samme figuren som i kapittel 1.4.1, og vi viser til den overordnede beskrivelsen av prosessen der. Figuren viser prosessen slik den var før ansvar for å godkjenne endringer i nasjonale behandlingstjenester etc. ble lagt til departementet.
Vi har brukt følgende parametere til å vurdere prosessen:
- Er dette trinnet en kritisk del av prosessen? Hvorfor er det viktig? Hva tilfører det? Har den aktuelle delen av prosessen betydning for
- kunnskapsgrunnlag
- faglig forankring
- forankring i RHF
- tillit til tiltaket
- vurdering av regelverk
- Tidsbruk: hvor lang tid tar denne delen av prosessen, er det mulig å endre tidsbruk/"spare inn" noe på dette trinnet?
- Personressurser: Hva kreves av personressurser for å gjennomføre denne delen av prosessen?
- Representerer denne delen av prosessen en flaskehals som kan fjernes? Hvis den ikke kan fjernes, kan den gjøres smidigere?
- Annet som bør nevnes om dette trinnet?
Første del av prosess i RHF
Første del av prosess i RHF: Framskaffe kunnskapsgrunnlag, vurdere behandlingsmuligheter og test. Ansvar: Nyfødtscreeningen
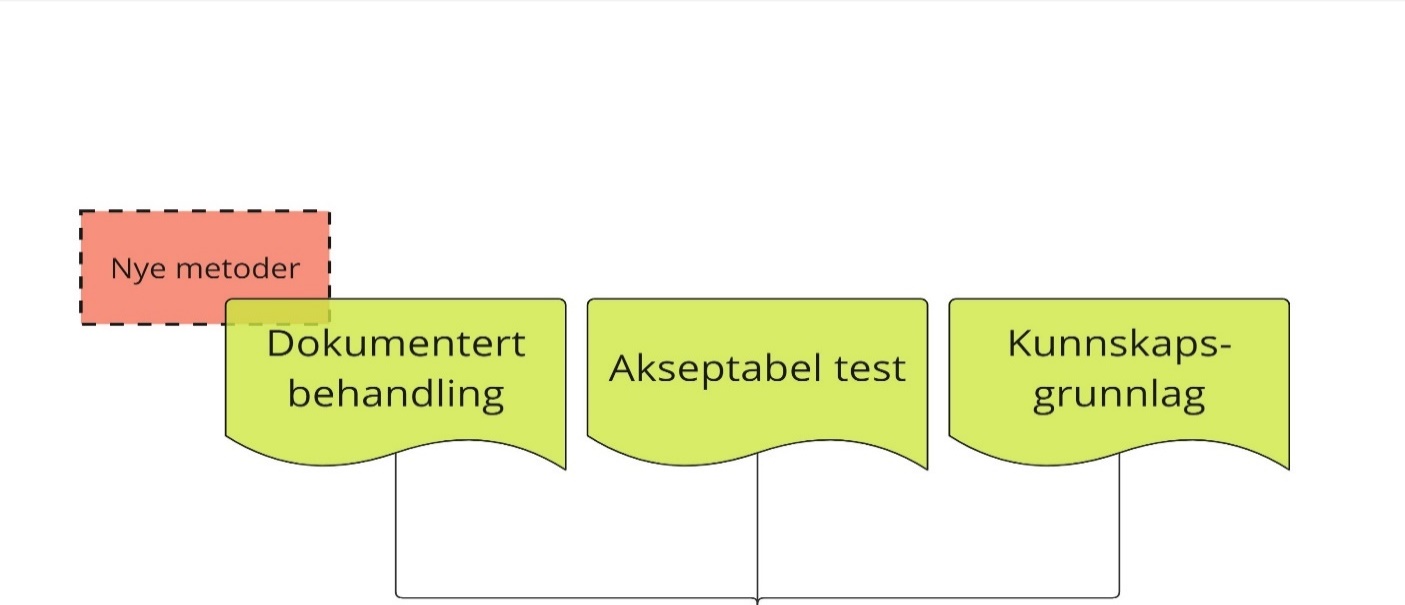
Forklaring til figuren
Kunnskapsgrunnlag:
Kunnskapsgrunnlaget omfatter dokumentasjon om forekomst av tilstanden, dokumentasjon for effekt av screening og for at behandling eller andre tiltak gir bedre effekt dersom det starter opp før symptomene utvikles. Kunnskapsgrunnlaget inneholder også dokumentasjon om forløp når behandling starter etter at barnet får symptomer, alder ved diagnose av tilstanden (det vil si hva som er vanlig når presymptomatisk testing gjennom nyfødtscreening ikke er tilgjengelig), om sykdomsforløp både med og uten behandling.
Det må finnes en sikker, presis og validert test, jf. screeningkriteriene:
5. Kriterier og prosedyrer for videre oppfølging av testpositive må være definert
6. Testmetoden skal være akseptabel for målgruppen
Dokumentasjon på behandling og dokumentasjon for at testen er akseptabel, er en del av kunnskapsgrunnlaget. Vi har valgt å illustrere dette med tre separate "bokser" for å tydeliggjøre at en prosess for å vurdere inkludering av en ny tilstand i nyfødtscreeningen kan ha ulike "startpunkter": det kan være nye behandlingsmuligheter, nye muligheter for testing, eller ny klinisk kunnskap, se. 3.3 (for eksempel om effekt av behandling på et tidlig tidspunkt/presymptomatisk).
Dokumentert behandling:
Det må finnes dokumentert behandling for tilstanden. I mange tilfeller kan tilstandene behandles med spesialtilpasset diett, kosttilskudd, SOS-regime eller liknende (se kapittel 7.1, som viser tilstandene som er inkludert i screeningen i dag, og aktuell behandling). Det må foreligge dokumentasjon på at tiltakene og/eller behandlingen har sykdomsbegrensende effekt. Den aktuelle behandlingen må være tilgjengelig gjennom offentlig helsetjeneste.
Hvis den aktuelle behandlingen er et legemiddel, må det foreligge godkjenning i EMA. Dersom legemiddelet skal brukes nasjonalt i spesialisthelsetjenesten, må behandlingen være vurdert eller godkjent av Nye Metoder før ev. screening kan starte. Derfor kan det være en avhengighet til Nye Metoder[46].
Akseptabel test:
Vurdere om testen er akseptabel omfatter metodeutvikling og validering.
Vurdering av denne delen av prosessen:
- Kritisk del av prosessen:
Å framskaffe kunnskapsgrunnlag, vurdere og validere testen og vurdere mulighet for behandling er en forutsetning for screening. Dette er også helt nødvendig for å sikre faglig forankring.
Screeningkriteriene må være oppfylt. Krav i bioteknologiloven § 5-7 må være oppfylt for den enkelte tilstanden, det vil si krav om at behandlingen kan forhindre eller redusere helseskade.
Kostnader knyttet til testing må vurderes. Dette omfatter arbeidskraft, reagenser, serviceavtaler og andre typer integrerte kostnader.
- Tidsbruk:
Innkjøring av testmetode, validering og kvalitetssikring kan ta et halvt til ett år. Helsepersonell som er involvert i behandling (regionalt og nasjonalt) må involveres i vurderingen av om tilstanden er aktuell for screening.
- Personell:
Innkjøring av metode krever en til to personer på lab. Helsepersonell som er involvert i behandling (regionalt og nasjonalt) må involveres i vurderingen av om tilstanden være aktuell for screening.
- Ev. flaskehalser og rom for forbedring:
Metodeutvikling og validering av testmetode er kritisk, men kan gjøres smidigere dersom prosessen kan starte i påvente av at behandlingen godkjennes (validering, bruke prøver fra friske og prøver fra syke, litteratursøk).
Innkjøring av testmetode inkluderer analyse av et stort materiale med kjente positive (prøver fra personer som har tilstanden), og dette er omfattende. Kan gjøres mer effektiv ved fortløpende lagring (inkl. digital lagring) av normaldatasett/biomarkører, se 5.9.
- Annet:
Tilstandene som det har vært aktuelt å screene for til nå, er sjeldne og har lav insidens. Datagrunnlaget for nytte av screening er ofte svært begrenset. Ved vurdering av kunnskapsgrunnlaget bør det være aksept for at datagrunnlaget er begrenset.
Det er behov for å klargjøre muligheten for å lagre biomarkørdata utover det som analyseres i screeningprogrammet; for bruk til metodeutvikling, vurdering av screening for nye tilstander og forskning.
Når biomarkører fra lagrede prøver analyseres for å vurdere inkludering av nye tilstander, kan det avdekkes biomarkørmønstre som tilsier sykdom – såkalt utilsiktede funn. Det kan for eksempel være funn i prøver som tidligere er klassifisert som screeningnegative, fordi tilstanden ikke var inkludert i screeningen tidligere. Det må avklares hvordan slike funn skal håndteres.
Andre del av prosessen i RHF
Andre del av prosessen i RHF: vurdering av forslag i RHF og søknad om endring av tjenesten.
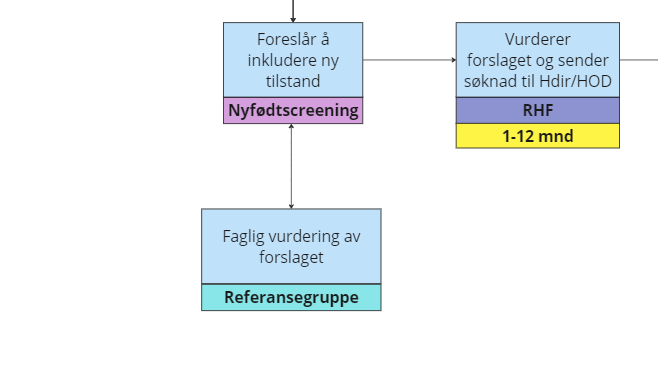
Forklaring til figuren
Nyfødtscreeningen forankrer forslag om endring i nyfødtscreeningen/inkludering av ny tilstand med referansegruppa[47] for den nasjonale behandlingstjenesten.
Deretter må forslaget forankres i RHF-strukturen. Bl.a. må ev. økonomiske konsekvenser vurderes. Søknad om endring i den nasjonale behandlingstjenesten sendes fra RHF til Helse- og omsorgsdepartementet/Helsedirektoratet[48].
Forslag om endring kan også innebære utfasing av en eller flere tilstander fra screeningen, men det har hittil ikke vært aktuelt.
Vurdering av denne delen av prosessen:
- Kritisk del av prosessen:
Forankring med referansegruppa er en kritisk del av prosessen. Dette har betydning for tillit til tiltaket. Forankring med RHF-strukturene er bl.a. nødvendig for å sikre finansiering etc. slik at screeningen kan gjennomføres. Ifølge gjeldende regelverk[49] for nasjonale tjenester må alle RHF stille seg bak en søknad om å utvide nyfødtscreeningen, og dette må dokumenteres i søknaden.
- Tidsbruk:
Når kunnskapsgrunnlaget etc. er avklart, kan nyfødtscreeningen ved OUS ferdigstille søknaden [54]. Forankring i RHF kan ta flere måneder.
- Personell:
Prosessen involverer personell ved Nyfødtscreeningen, klinikere ved andre sykehus og RHF-nivået.
- Ev. flaskehalser og rom for forbedring:
Forankring i RHF kan ta lang tid. Det bør være mulig å legge opp prosessen for forankring i RHF mer smidig.
Det er nødvendig å gå gjennom de formelle kravene til søknader om endring etter forskrift om krav til spesialisthelsetjenester, godkjenning av nasjonale tjenester i spesialisthelsetjenesten og bruk av betegnelsen universitetssykehus. Det bør vurderes om inkludering av nye tilstander kan gjøres uten ny søknad etter dette regelverket, ev. om det er mulig å forenkle prosessen.
- Annet:
Nyfødtscreeningen har i dag en referansegruppe som gir råd om utvidelse av screeningprogrammet. Referansegruppa har representanter fra alle RHFene, en representant fra Bioteknologirådet, og representanter fra brukerorganisasjoner.
Det er aktuelt å vurdere om referansegruppa kan ha en mer formalisert rolle som faglig forankringspunkt for spørsmål om nyfødtscreeningen bør utvides. Spørsmål om utvidelse av screening er i hovedsak en faglig vurdering av kunnskapsgrunnlaget og screeningkriteriene. Fagpersoner i nyfødtscreeningen, referansegruppen for den nasjonale tjenesten og brukerrepresentanter bør ha sentrale roller i slike prosesser siden de har kunnskap om og erfaring med nyfødtscreening, de aktuelle diagnosene og konsekvenser ved sen diagnostikk. En utvidet referansegruppe vil kunne ivareta dette. Det er aktuelt å se på sammensetning av referansegruppa i en slik sammenheng.
Prosessen i RHFene bør kunne gjøres mer strømlinjeformet, slik at tiden det tar å forankre forslaget kortes ned. Hvis behandlingen for en tilstand som er aktuell å ta inn i nyfødtscreeningen trenger godkjenning fra Nye Metoder, og Nye metoder har godkjent den, bør det ta kort tid å få forankret av et forslag om screening.
Det er nødvendig å avklare om inkludering av nye tilstander i nyfødtscreeningen trenger godkjenning etter forskrift om krav til spesialisthelsetjenester, godkjenning av nasjonale tjenester i spesialisthelsetjenesten og bruk av betegnelsen universitetssykehus. Tjenesten er godkjent for å gjennomføre screening. Utvidelse eller endringer av nyfødtscreeningen er en del av dette. Endringer i hvilke tilstander som det screenes reiser ikke samme type problemstillinger som andre typer nasjonale eller flerregionale tjenester. Presymptomatisk diagnostikk for disse hypersjeldne tilstandene krever høyspesialisert kompetanse, som gjør det lite aktuelt at flere HF skal ha ansvar for dette. Det kan derfor være grunnlag for å endre fortolkning av forskriften når det gjelder nyfødtscreeningen.
Vurdering av søknad i Hdir
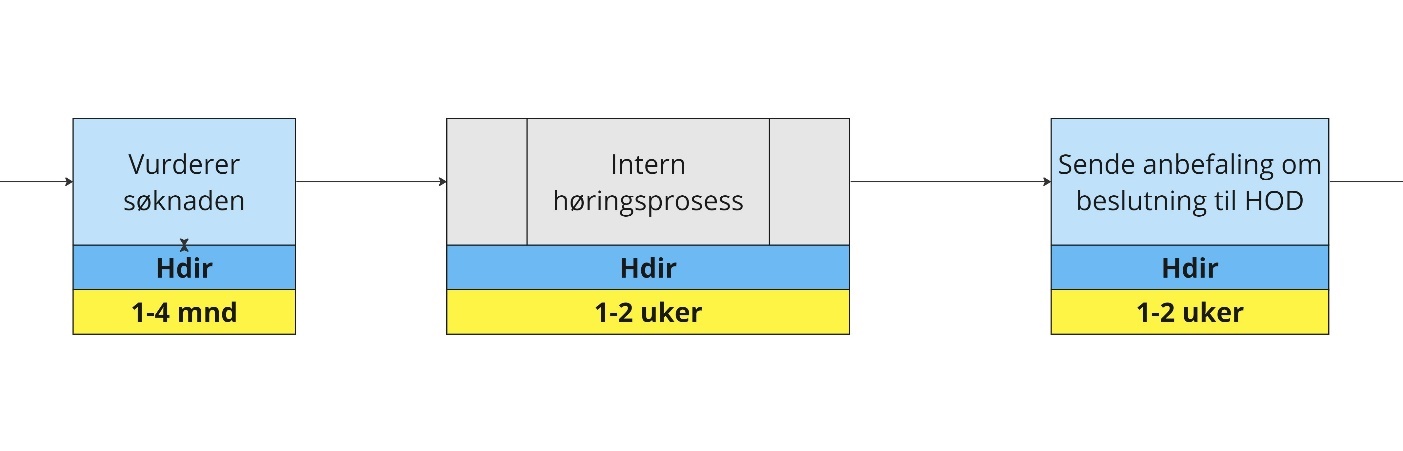
Forklaring til figuren
Helsedirektoratet vurderer søknaden:
Helsedirektoratet vurderer om dokumentasjonen er i samsvar med krav som stilles for denne type søknader, og kontrollerer at søknaden beskriver testens egenskaper, nytte/effekt av screening, inkludert screeningkriteriene. Helsedirektoratet skal også vurdere om vilkår for presymptomatisk genetisk undersøkelse av barn i bioteknologiloven § 5-7 er oppfylt.
Intern høringsprosess:
Helsedirektoratets vurdering forankres internt i organisasjonen, og det kan være aktuelt å behandle saken i Helsedirektoratets ledermøte. Bred forankring i direktoratet bidrar til å skape tillit til tiltaket.
Sende anbefaling om beslutning til HOD:
Helsedirektoratet ferdigstiller og oversender sin anbefaling til HOD. Formkrav til anbefalingen er noe annerledes enn formkrav til saksfremlegg i Helsedirektoratets ledermøte, og krever derfor noe ekstra saksbehandlingstid.
Vurdering av denne delen av prosessen:
- Kritisk del av prosessen:
Kunnskapsgrunnlaget og begrunnelse for søknaden må være tilstrekkelig. Testens egenskaper må beskrives – at den er akseptabel og gir sikre resultater (høy sensitivitet og spesifisitet). Videre må det være dokumentasjon for at tilstanden er alvorlig, og at den kan forebygges eller behandles. Hvis det er vanskelig å oppfylle krav om behandling bør det begrunnes særlig godt hvorfor det allikevel bør være screening, for eksempel at tett oppfølging etc. reduserer helseskade.
Videre håndtering hos et myndighetsorgan (Hdir) bidrar til å skape tillit til tiltaket.
- Tidsbruk:
Tidsbruk for Helsedirektoratets behandling av søknaden avhenger bl.a. av dokumentasjonen som er levert fra RHF. Dersom det er behov for å innhente mer dokumentasjon, eller behov for andre avklaringer med RHF/nyfødtscreeningen, vil det føre til at prosessen i Hdir tar lengre tid.
Behandling av søknad/forslag og forankring internt i direktoratet konkurrerer med andre oppgaver, derfor er tidsbruk også avhengig av kapasitet og prioritering internt i direktoratet. Behandling av søknaden må prioriteres for å sikre fremdrift.
Hvis saken skal legges fram for og besluttes av ledermøtet i Helsedirektoratet, må saken høres i organisasjonen. Det tar vanligvis to til tre uker å gjennomføre en prosess med høring og ledermøtebehandling, da er tid for å utarbeide saksframlegg inkludert.
Eksempler på tidsbruk
Søknad om inkludering av spinal muskelatrofi (SMA) ble sendt til Helsedirektoratet i 4. november 2020. Hdir sendte sin anbefaling til HOD 15. februar 2021.
- Personell:
Saksbehandlere i Hdir, og i tillegg noe kapasitet hos ledere og ledermøtet i Helsedirektoratet.
- Ev. flaskehalser og rom for forbedring:
Mulighet for å redusere tidsbruk dersom oppgaven gis en klar prioritet i direktoratet. Prosessen kan også kortes noe ned dersom ledermøtebehandling utgår, men Ledermøtebehandling og prosess som involverer større deler av organisasjonen vil sikre en helhetlig vurdering av saken i direktoratet. Helsedirektoratets anbefaling bør forankres i organisasjonen.
- Annet:
Det er nødvendig å avklare om forskrift om krav til spesialisthelsetjenester, godkjenning av nasjonale tjenester i spesialisthelsetjenesten og bruk av betegnelsen universitetssykehus gir rom for tolkning av hva slags endringer som krever ny søknad og godkjenning (se forskriften § 4-1 første ledd). Se også forrige punkt.
Prosess i HOD
Prosess i HOD: Vurderer anbefaling fra Hdir og gjennomfører høringsprosess og ev. endring i forskrift om genetisk masseundersøkelse av nyfødte.
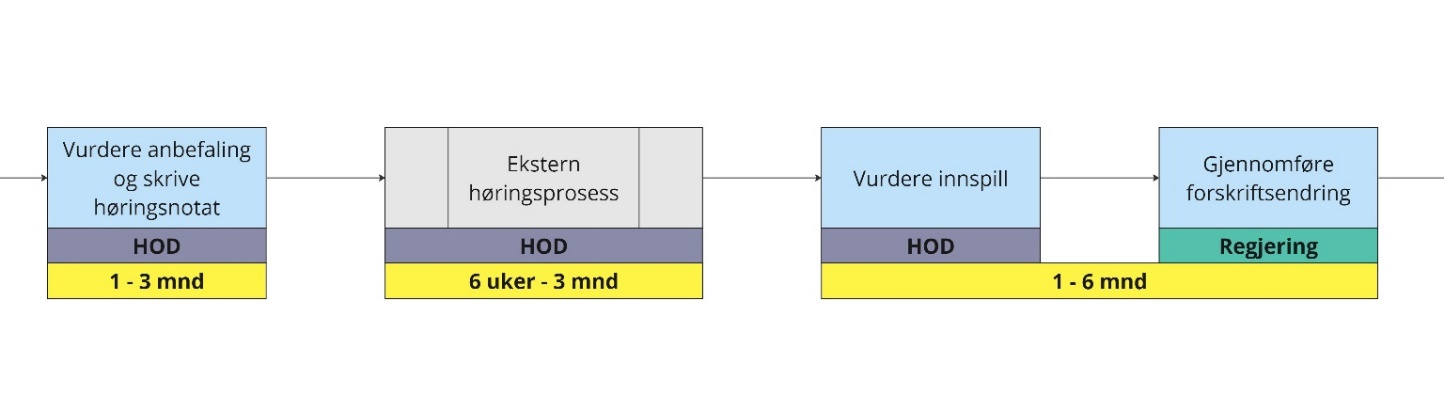
Forklaring til figuren
Helse- og omsorgsdepartementet (HOD) mottar Helsedirektoratets vurdering av søknaden. Hvis departementet er enige i at tilstanden bør inkluderes i nyfødtscreeningen, må HOD forberede høringsnotat med forslag om endring i forskrift om genetisk masseundersøkelse av nyfødte, og sende forslaget på høring. En høring varer fra 6 uker til 3 måneder. Etter høringen må høringssvar oppsummeres. Ev. endring i forskriften vedtas av Kongen i Statsråd.
Fra 1. januar 2024 er det HOD som godkjenninger ev. endringer i nasjonale behandlingstjenester. Derfor kommenterer vi dette i kapittel 5.
Vurdering av denne delen av prosessen:
- Kritisk del av prosessen:
Kvalitetssikring av forslaget er nødvendig, men dette skjer i praksis før anbefaling oversendes til HOD. Økonomiske konsekvenser må vurderes, noe som inngår som en del av kunnskapsgrunnlaget og i vurderingen i RHF.
Transparens og tydelig prosess gir tillit til tiltaket. En høring om endring i forskrift om genetisk masseundersøkelse legger opp til en demokratisk prosess, og kan bidra til å belyse ev. etiske og samfunnsmessige konsekvenser som ikke er vurdert tidligere i prosessen. Disse hensynene kan også ivaretas på andre måter.
- Tidsbruk:
HOD trenger tid til å vurdere anbefalingen fra Hdir og ev. forberede høringsnotat om endring i forskriften om genetisk masseundersøkelse. Høring varer vanligvis fra seks uker til tre måneder. Oppsummering og vurdering av høringsinnspill og endring av forskriften vil også ta noe tid.
Eksempler
"Inkludering av spinal muskelatrofi i 2021". Helsedirektoratet sendte sin anbefaling til HOD 15. februar 2021. Forslaget til endring i forskriften om genetisk masseundersøkelse ble sendt på høring 29. mars 2021[50], med frist 10. mai 2021 (6 uker). Forskriften ble endret 11. juni 2021[51], og endringen trådte i kraft fra 1. september 2021.
"Inkludering av SCID (og andre alvorlige T-celle defekter) og HMG i 2017/2018"[52]. Høring av endring i forskrift om genetisk masseundersøkelse og behandlingsbiobankloven var på høring fra 2. juni 2017 til 4. september 2017 (3 måneder, fordi forslaget omfattet lovendring). Forskrift om genetisk masseundersøkelse ble endret 13. oktober 2017[53], og endringen trådte i kraft 1. januar 2018.
- Personell:
Prosessen krever ressurser hos HOD, regjeringen og andre aktører.
- Ev. flaskehalser og rom for forbedring:
Forskriftsendringer med tilhørende høring tar tid, blant annet tar det tid å utarbeide og forankre et høringsnotat.
I de siste høringsprosessene er det få eller ingen uttalelser som går imot forslag om å inkludere de foreslåtte tilstandene i nyfødtscreeningen.
Vi stiller spørsmål om vurdering av etiske og samfunnsmessige konsekvenser krever en høringsprosess, eller om dette kan ivaretas på andre måter. Spørsmål om utvidelse av nyfødtscreeningen er i stor grad er en medisinskfaglig vurdering, og en vurdering av screeningkriteriene. Det er spørsmål om inkludering av nye tilstander i nyfødtscreeningen alltid egner seg for det høringsformatet som endring i en forskrift krever.
- Annet:
Det må vurderes om det er nødvendig at hjemmel for å fastsette nye tilstander ligger hos Kongen i statsråd.
En mulighet er å la listen over sykdommer framgå av et vedlegg til forskriften. Det bør da vurderes om forskriften skal inneholde tydeligere kriterier for inkludering av nye tilstander. Myndighet til å fastsette endringer i nyfødtscreeningen kan for eksempel legges til Helse- og omsorgsdepartementet.
De bør etableres en ny og tydelig prosess for beslutning om å inkludere nye tilstander i screeningprogrammet. Det er også aktuelt å presisere og klargjøre kriterier for screening av nyfødte, slik det bl.a. er gjort i Sverige.
Forskriften om genetisk masseundersøkelse må fremdeles gi unntak fra krav om skriftlig samtykke og genetisk veiledning jf. bioteknologiloven §§ 5-4 første ledd og 5-5 første ledd.
Prosess i Hdir og RHF
Prosess i Hdir og RHF: Hdir/HOD godkjenner endringer i den nasjonale behandlingstjenesten og RHF ved Nyfødtscreeningen gjennomfører endringen
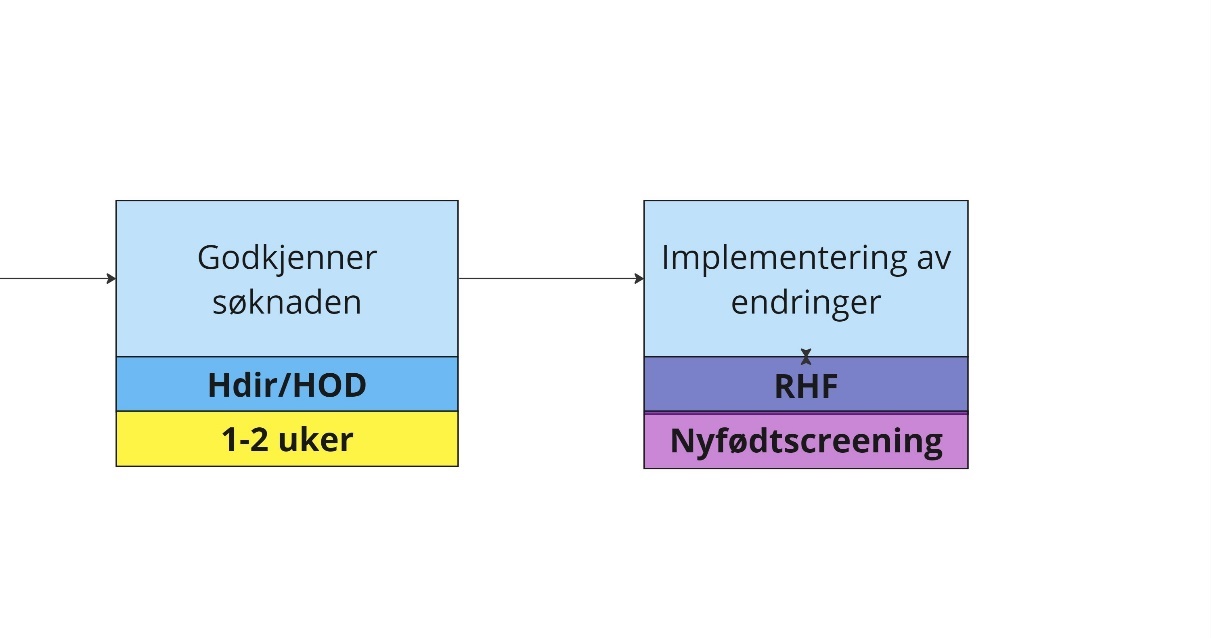
Forklaring til figuren
Før ansvar for godkjenning av endringer i nasjonale behandlingstjenester etc. ble overført til HOD fikk Helsedirektoratet får tilbakemelding om at forskriften om genetisk masseundersøkelse blir endret. Direktoratet godkjente søknaden om endring i den nasjonale behandlingstjenesten, og sender svarbrev til RHF/Nyfødtscreeningen. Nyfødtscreeningen/RHF implementerer endringen i screeningprogrammet, og iverksetter den så raskt som mulig etter at forskriftsendringen har trådt i kraft. Etter 1. januar 2024 er det departementet som godkjenner søknader og gir tilbakemelding til RHF.
- Kritisk del av prosessen
Når det er besluttet at det skal screenes for en ny tilstand, bør søknad godkjennes raskt. Implementering bør skje raskt for å sikre tillit til tiltaket. Nyfødte som får påvist en av tilstandene det screenes for, må få øyeblikkelig hjelp.
- Tidsbruk
Godkjenning av søknaden trenger ikke ta mer enn en til to uker. Arbeid med implementering kan starte så fort det er bestemt at forskriften skal endres, men screeningprogram som inkluderer ny tilstand kan ikke tilbys før endring av forskrift om genetisk masseundersøkelse har trådt i kraft.
- Personell:
Krever noe saksbehandling i direktorat/departement. Nyfødtscreeningen må ha utarbeidet informasjonsmateriale, og analysen må være etablert og validert etc. Det er den som regel, fordi dette er en del av kunnskapsgrunnlaget.
- Ev. flaskehalser og rom for forbedring:
Endringer i den nasjonale behandlingstjenesten skal godkjennes etter forskrift om krav til spesialisthelsetjenester, godkjenning av nasjonale tjenester i spesialisthelsetjenesten og bruk av betegnelsen universitetssykehus. Det må avklares om nye tilstander kan legges til nyfødtscreening uten søknad om endring av tjenesten. Som ledd i vurdering av forslag om forslag om endring av nyfødtscreeningen vil Helsedirektoratet uansett vurdere om dette innebærer endring av tjenesten.
- Annet:
Tid er kritisk. Når det finnes en godkjent behandling for en tilstand som oppfyller krav til screening av nyfødte, bør det ta kort tid å få inkludert tilstanden i screeningprogrammet.
Oppsummert – hva kan forbedres
Gjennomgang av prosessen for inkludering av nye tilstander i nyfødtscreeningen har avdekket en rekke forbedringspunkter. Deler av prosessen framstår som unødvendig tidkrevende, komplisert og byråkratisk.
Ny behandling er som regel godkjent lenge før forskriften blir endret. Et eksempel er antisens oligonukleotid-terapi (Spinraza) som fra oktober 2018 og i mer enn 2,5 år var godkjent som behandling av spinal muskelatrofi (SMA) før screening var på plass september 2021 (se omtale i kapittel 7.2). Barn født i denne perioden mistet muligheten til å få behandling før uopprettelig nerveskade var skjedd. Et annet eksempel er beslutning om å tilby genterapi (Libmeldy) som behandling for metakromatisk leukodystrofi (MLD) 19. juni 2023[54]. Søknad om endring av nyfødtscreeningen for å inkludere MLD ble sendt fra Nyfødtscreeningen august 2023 via ledelse OUS til HSØ RHF, og Helsedirektoratet mottok søknaden i oktober 2023. Helsedirektoratet sendte sin vurdering til HOD i februar 2024. Etter gjeldende forskrift kan beslutning om endring i nyfødtscreeningen ikke gjennomføres før forslaget har vært på høring og endringen trer i kraft. Dette er neppe klart før utpå høsten 2024.
Konkrete forbedringspunkter omfatter:
- tydeliggjøre vektlegging av de medisinskfaglige vurderingene og screeningkriteriene i spørsmål om inkludering av nye tilstander (eller utfasing av tilstander)
- se på mulighet for endring i forskrift om genetisk masseundersøkelse slik at inkludering av nye tilstander ikke krever en forskriftsendringsprosess (høring fra HOD, beslutning fra Kongen i statsråd etc.)
- vurdere om det er nødvendig å sende søknad om endring etter forskrift om krav til spesialisthelsetjenester, godkjenning av nasjonale tjenester i spesialisthelsetjenesten og bruk av betegnelsen universitetssykehus.
- mer effektiv saksgang etter at Referansegruppa for nyfødtscreeningen[55] har vurdert forslaget, og ev. tidsfrister for saksbehandlingen
- se på sammensetning og mandat for Referansegruppa for nyfødtscreeningen
- se på mulige forenklinger i flere deler av prosessen
[48] Til Hdir før 1.1.2024, nå til HOD med kopi til Hdir. Det er fremdeles Hdir som vurderer søknaden og gir en anbefaling til HOD.
[49] Forskrift om krav til spesialisthelsetjenester, godkjenning av nasjonale tjenester i spesialisthelsetjenesten og bruk av betegnelsen universitetssykehus https://lovdata.no/forskrift/2010-12-17-1706 (lovdata.no)
[51] Forskrift om endring i forskrift 29. juni 2007 nr. 742 om genetisk masseundersøkelse av nyfødte (lovdata.no)
[53] Forskrift om endring i forskrift 29. juni 2007 nr. 742 om genetisk masseundersøkelse av nyfødte (lovdata.no)
[55] Nasjonal behandlingstjeneste for screening av nyfødte og avansert laboratoriediagnostikk ved medfødte stoffskiftesykdommer