Hensikten med genetisk analyse ved malign blodsykdom er å undersøke forekomst av og karakterisere genetiske avvik i den maligne klon. Påvisning av kreftspesifikke avvik kan bidra til å skille malign fra benign tilstand, og bidra til å klassifisere neoplasien etter WHOs retningslinjer for diagnostikk (Swerdlow et al., 2017).
Mutasjonsstatus er assosiert med forventet behandlingsrespons og prognose og kan også påvirke valg av behandling. Påvist genetisk endring kan i mange tilfeller benyttes for vurdering av behandlingsrespons og minimal restsykdom (MRD). Ved mistanke om residiv kan genetisk analyse benyttes for å skille et residiv fra en behandlingsrelatert leukemi.
Undersøkelse for alle synlige kromosomale avvik kan gjøres ved bruk av G-båndsanalyse.
Målrettet undersøkelse på definerte avvik kan gjøres ved hjelp av fluorescens in situ hybridisering (FISH) eller ved PCR- baserte teknikker. PCR er rask og sensitiv (≥1x10–4). FISH derimot har lavere sensitivitet: 5–15 % avhengig av probe. FISH er mer anvendbar i tilfeller hvor samme gen kan inngå i flere ulike translokasjoner, eller hvor det er uvanlige bruddpunkt.
Mutasjoner i enkeltgener undersøkes med PCR. Hovedsakelig benyttes DNA, men analysen kan også utføres på RNA.
Deteksjon av tap eller tillegg av genmateriale og tap av heterozygositet kan gjøres med DNA matriser. Måling av genekspresjonsstatus i enkeltgener eller i hele transkriptomet kan gjøres ved hjelp av ekspresjonsmatriser. Disse matrisebaserte analysene inngår pt. ikke i noe diagnostisk tilbud i Norge.
Hver av de ulike klassene innen hematologiske maligniteter har sine spesifikke genetiske avvik. Det er derfor essensielt at det gis kortfattede kliniske opplysninger med klar problemstilling og dersom tentativ diagnose endres etter svar fra andre undersøkelser, bør dette videreformidles.
Bruken av genetiske analyser ved prognosesetting og behandlingsplanlegging ved maligne blodsykdommer er i meget rask utvikling, og dette handlingsprogrammet gir ikke komplett informasjon. Behovet for flere og mer kompliserte analyser og korte responstider er økende og kostnadskrevende.
Hvor skal prøven sendes
For genetiske analyser som beskrives i handlingsprogrammet: se tabell 3.1.
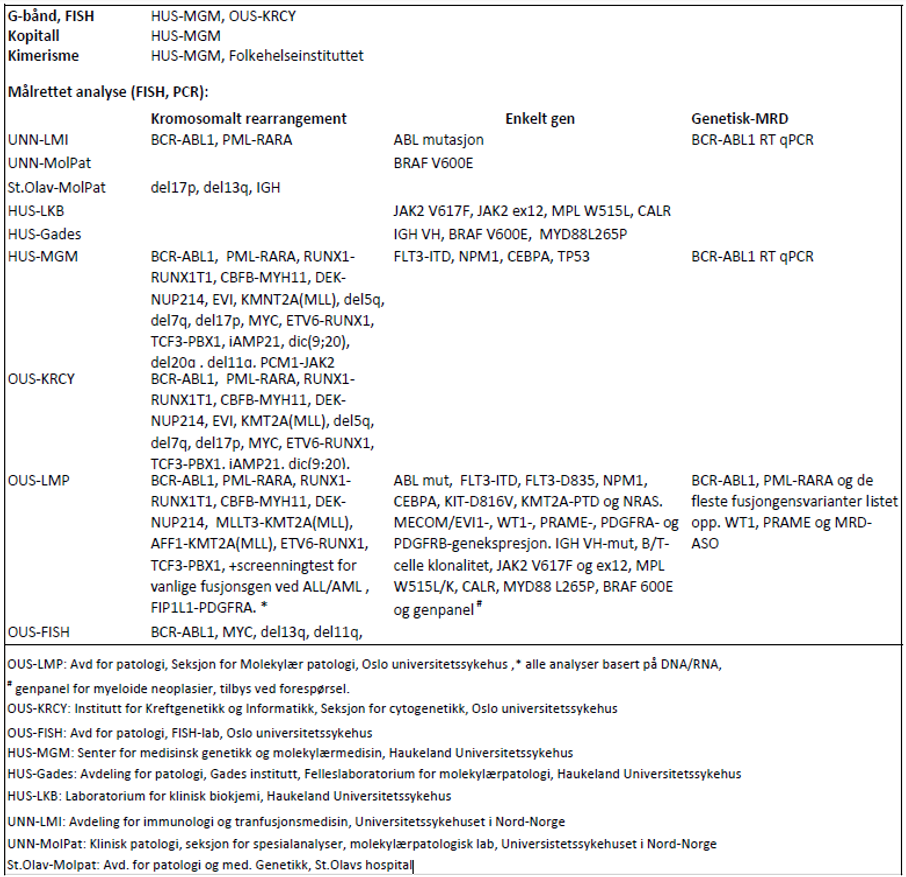
Laboratoriene har flere analyser i sitt tilbud enn det som fremkommer av tabellen og det henvises for fullstendig analyseoversikt og oppdaterte adresser til www.genetikkportalen.no. Her vil en også finne oversikt over andre aktuelle genetiske analyser som utføres i Norge.
Prøvebehandling/transport
For diagnostiske prøver bør prøven tas før behandlingen starter.
Cytogenetisk analyse (G-bånd og FISH) krever levende celler. Prøven må derfor alltid oppbevares ved romtemperatur; mellom 16–22 °C (unngå temperaturer under 4 °C og over 30 °C). Spesielle forbehold må tas på vinterstid for å unngå nedkjøling (isolasjon). Dersom transportfirma benyttes, må de gjøres oppmerksom på dette. Kortest mulig transporttid direkte til laboratoriet er nødvendig, maks 2 døgn. mRNA for RNA-basert diagnostikk er ustabilt og bør være på laboratoriet innen 24 timer. Ved HUS benyttes spesialrør (PAX) som stabiliserer RNA slik at den kan oppbevares inntil 72 timer i romtemperatur.
DNA-basert diagnostikk krever ikke viable celler. DNA er mer stabilt og tåler lenger transporttid.
Laboratoriene som utfører disse analysene har stengt i helgen og på helligdager. Cytogenetisk analyse krever dyrkning av celler og bør derfor tas mandag-torsdag. Med mindre annet er avtalt vil prøver som mottas fredag bli dyrket over helg, noe som ofte medfører færre metafaser som kan analyseres. Prøver for RNA-basert diagnostikk bør også tas mandag-torsdag dersom prøven må transporteres over lengre avstand, evt benytte spesialrør (PAX). Dersom behandling må påbegynnes utenfor åpningstiden bør det tas representative prøver før oppstart. Disse bør oppbevares i romtemperatur inntil de oversendes til laboratoriet. Hvis spesielle genetiske avvik kan utelukkes med FISH, vil dette kunne utføres på beinmargsutstryk.
Presis og korrekt merking av alle glass, rekvisisjon og forsendelsespapirer er viktig. Anfør om prøvesvaret haster. Gi eventuelt laboratoriet beskjed om at prøve er sendt, spesielt gjelder dette prøver som tas på fredag/før helligdager eller i tilfeller hvor prøvesvaret haster.
Prøvemateriale
For de fleste maligne sykdommer omfattet i dette handlingsprogrammet er det ønskelig med beinmargsmateriale, primært aspirat. Ved akutte leukemier kan perifert blod benyttes dersom det er påvist over 10 % blaster. Ved kroniske tilstander kan blod benyttes dersom aspirat er vanskelig å gjennomføre. Blod foretrekkes ved KLL. For MRD undersøkelser er det spesielt ønskelig med beinmarg, unntatt ved KML. Spinalvæske, ascites og finnålsaspirat ved mistanke om infiltrasjon i aktuelt organ kan også benyttes. Ved dry tap kan beinmargsbiopsi benyttes.
Problemstillinger for genetiske analyser
Normalt bør alltid blod- eller beinmargsutstryk vurderes før rekvirering for klarest mulig problemstilling. Dersom diagnose er usikker ved forsendelse må informasjon videreformidles til laboratoriet ved endringer eller bekreftelse av diagnose.
G-båndsanalyse benyttes for screening etter alle mulige kromosomale avvik. Metoden er tidkrevende og har begrenset sensitivitet. Den maligne klon må utgjøre så stor andel i prøvematerialet at den oppdages i minst 2–3 celler ved analyse av 20 metafaser.
Målrettet undersøkelse etter spesifikke genetiske avvik gjøres enten med bruk av FISH eller PCR. PCR er mest sensitiv. FISH har en fordel fordi et gen kan ha flere translokasjonspartnere, eller bruddstedet i genet kan variere mellom pasienter. Tap og tillegg av genområder eller kromosomer kan påvises med FISH.
For å benytte målrettet genetisk analyse for monitorering av behandlingsrespons (minimal restsykdom, MRD) må det foreligge et kjent avvik. Indikasjon for slik analyse foreligger dersom resultatet kan få praktisk konsekvens for behandlingen av pasienten, eller dersom undersøkelsen gjøres som ledd i en vitenskapelig undersøkelse. Det er stor forskjell i sensitivitet mellom de ulike genetiske metodene.
- Genetisk diagnostikk er indisert ved berettiget mistanke om akutt og kronisk leukemi, MDS, MPN og myelomatose (Haferlach et al., 2007).
Hvilke analyser kan/bør utføres
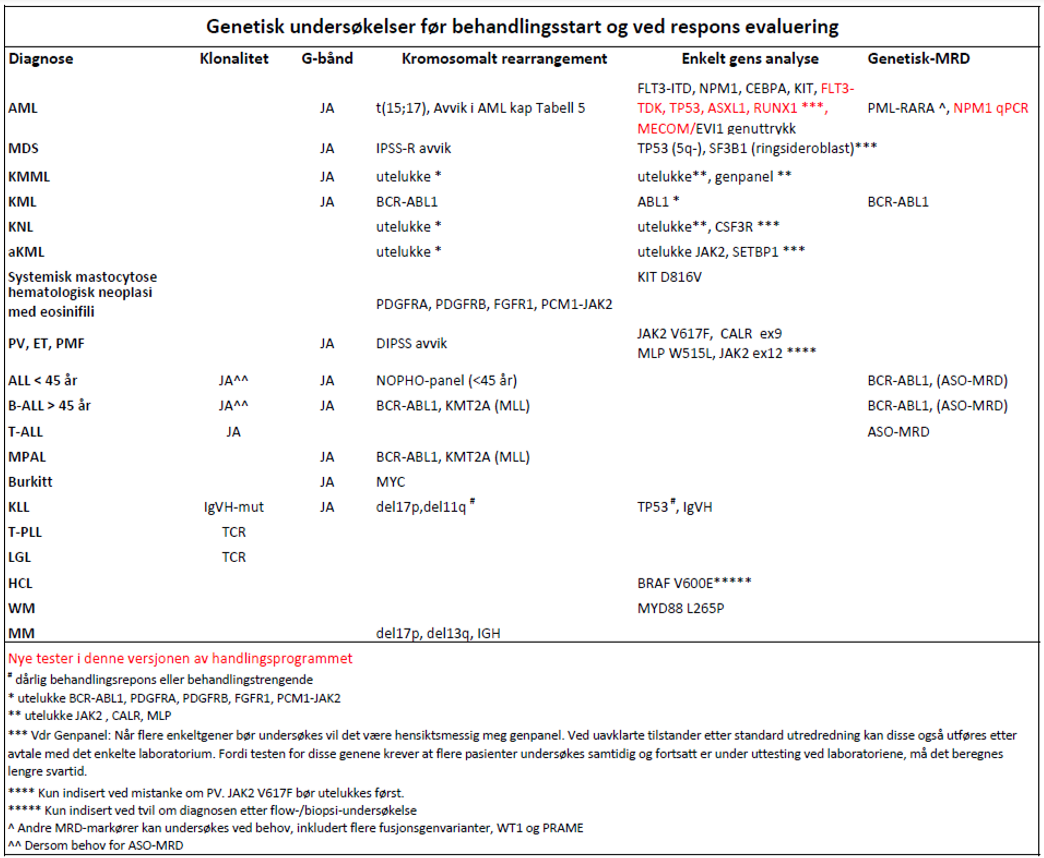
B-linje-ALL
Pasienter ≤45 år i NOPHO protokoll (vil endres ila 2018 ved oppstart av ALLtogether):
Analysen kan utføres på beinmarg, blod kan benyttes ved >30 % blaster
G-båndsanalyse. Ved normale funn analyseres minst 20 metafaser. Ved avvikende funn bør minst 10 metafaser analyseres (Hastings et al., 2013).
Målrettet analyse ved FISH eller RT-PCR: t(9;22) / BCR-ABL1, t(12;21) / ETV6-RUNX1, t(1;19) / TCF3-PBX1, dic(9;20), 11q23 / KMT2A (MLL) rearrangement, ic21amp.
Dersom RT-PCR er benyttet for KMT2A og ingen andre kromosomale rearrangement er påvist, bør FISH mot KMT2A utføres (nær 200 ulike KMT2A rearrangement er beskrevet og RT-PCR assayene er kun mot de vanligste).
Kopitallsanalyse anbefales dersom avvik ikke påvises ved de andre analysene, eller det er behov for verifikasjon av mistenkte ubalanserte avvik.
Hypodiploiditet måles ved flowcytometri og ved kopitallsanalyse.
Farmakogenetikk: Thiopurine methyltransferase (TPMT) genotyping av minimum G460A og A719G (EDTA blod, St. Olav, Avd for medisinsk genetikk, Medisinsk Genetisk laboratorium).
Pasienter ≥45 år:
G-båndsanalyse. Ved normale funn analyseres minst 20 metafaser.
Målrettet analyse: t(9;22) / BCR-ABL1, 11q23 / KMT2A (MLL) rearrangement.
Dersom RT-PCR er benyttet for KMT2A og ingen andre kromosomale rearrangement er påvist, bør FISH mot KMT2A utføres (nær 200 ulike KMT2A rearrangement er beskrevet og RT-PCR assayene er kun mot de vanligste).
Burkitt lymfom
Analysen bør utføres på beinmarg evt lymfeknute
G-båndsanalyse. Ved normale funn analyseres minst 20 metafaser (Hastings et al., 2013).
Målrettet analyse: 8q24 / MYC rearrangement
KLL
Analysen kan utføres på blod.
Ved diagnose:
- PCR: IGVH mutasjonsstatus
- Før behandling eller ved progresjon:
- G-båndsanalyse
- FISH minst 200 interfaser: del(17p13) / TP53
- Evt. del(11q22), del(6q), del(13q14.3) og trisomi 12
- PCR: TP53 (ekson 4–10) mutasjonsstatus
- del17p/TP53 bør gjentas ved hver behandlingslinje.
MDS
- Analysen bør utføres på beinmarg.
- G-båndsanalyse. Ved normale funn analyseres minst 20 metafaser (Hastings et al., 2013).
- Målrettet analyse: Dersom det ikke er 20 analyserbare metafaser av brukbar kvalitet, alternativt interfase FISH undersøkelse for -5/5q / EGR1, -7/7q /D7S486, +8 og del(20q) / D20S108, i(17q / TP53), 3q26 / EVI rearrangement
- Dersom ringsideroblaster: sekvensering av SF3B1 ekson 14–15 (Arber et al., 2016)
- MDS med isolert del(5q): sekvensering av TP53 mutasjon ekson 4–10 (Arber et al., 2016)
- Alle pasienter med MDS og KMML som er aktuelle for allogen stamcelletransplatasjon bør få utført neste generasjons sekvensering (NGS), myeloid panel (dvs. dypsekvensering ved hjelpe av TruSightMyeloid Sekvenserings panel)
AML
- Analysen kan utføres på beinmarg, blod kan benyttes ved >30 % blaster.
- G-båndsanalyse. Ved normale funn analyseres minst 20 metafaser (Hastings et al., 2013).
- Ved normal karyotype eller mislykket analyse bør målrettet analyse utføres på: t(15;17) / PML-RARA, t(8;21) / RUNX1-RUNX1T1, inv(16) / CBFB, t(9;22) / BCR-ABL1, 11q23 / KMT2A (MLL) rearrangement, 3q26 / MECOM (EVI) rearrangement, 5q- / EGR1, 7q-/-7 /D7S486, t(6;9) / DEK-NUP214, se tabell nedenfor.

Genpanel vil kunne benyttes der det er tilstrekkelig med deteksjon av 5 % av cellepopulasjonen og calling algoritmene klarer å identifisere mutasjonen. Denne analysen er kun tilgjengelig ved OUS-LMP.
For FLT3-ITD: semikvantiativ endepunkts PCR stoppet i eksponentiell fase separert på kapilærelektroforese. Ved påvist ITD beregnes ratio ut fra anbefaling fra ELN: areal under kurvene for FLT3-ITD (summert ved flere topper) over FLT3-normal allel. Det må gjøres oppmerksom på at HOVON beregner FLT3 ratio som areal FLT3-ITD (hovedtopp) / FLT3-ITD+FLT3-normal.
APL-mistanke: t(15;17) / PML-RARA, evt andre 17q21 / RARA rearrangement med RT-PCR. FISH kan benyttes dersom RNA ikke foreligger. MRD ved real time RT-PCR.
AML t(8;21): KIT ekson 8 med sekvensering og ekson 17 mutasjoner med sekvensering eller allelspesifikk analyse.
KML
Beinmarg sendes til cytogenetisk analyse («G-banding», karyotypering) og blod sendes til molekylær genetisk analyse (RT-PCR).
Cytogenetisk analyse bør utføres på beinmarg, men blod kan benyttes dersom >10 % blaster.
G-båndsanalyse ved diagnose: minst 3 celler med translokasjon som involverer kromosom 9q34 og 22q11, men helst 20 metafaser for å undersøke for klonale evolusjon (Hastings et al., 2013).
BCR-ABL1 fusjon skal verifiseres med målrettet analyse. RT-PCR basert analyse bør benyttes for å identifisere hvorvidt e13a2/e14a2 eller andre alternative transkript foreligger. Dette resultatet vil være av betydning for valg av analyse for å måle respons av behandling. FISH vil være aktuelt der vanlig t(9;22) ikke foreligger eller fusjon ikke er påvist med RT-PCR men kliniske symptomer stemmer med KML.
MPN (Polycytemia vera, Essensiell trombocytose, Primær Myelofibrose, Kronisk nøytrofil leukemi)
JAK2V617F mutasjon med allelspesifikk metode. Dersom negativ, vurderes mutasjonsanalyse for CALR (exon 9) og MPL W515L/K ved essensiell trombocytose og primær myelofibrose samt JAK2 ekson 12 ved polycytemia vera. Dersom de tre førstnevnte markørene er negative ved mistanke om primær myelofibrose, kan påvisning av andre hyppig forekommende mutasjoner (f.eks. ASXL1, EZH2, TET2, IDH1/IDH2, SRSF2, SF3B1) støtte at det foreligger klonal sykdom (Arber et al., 2016).
For JAK2V617F er det anbefalt å ha en analytisk sensitivitet på minimum 1 %, men testen må ikke være for sensitiv da svært lave JAK2V617F mutasjon er funnet i friske individer (<0,1 %) (Lippert et al., 2009; Wang et al., 2008).
(Blod kan benyttes.)
For risikostratifisering ved primær myelofibrose: G-båndsanalyse. Sekvensering av ASXL1, EZH2, SRSF2 eller IDH1/2 kan vurderes.
Kronisk nøytrofil leukemi:
CSF3R T618I mutasjon eller annen aktiverende mutasjon av CSF3R (Arber et al., 2016).
Systemisk mastocytose
PCR: KITD816Vmutasjon med allelspesifikk metode med minimum 0,1 % sensitivitet (blod eller benmarg)
Myeloide og lymfoide neoplasmer assosiert med eosinofili
FISH/RT-PCR: PDGFRB, PDGFRA, FGFR1 rearrangement, PCM1-JAK2-fusjon (Arber et al., 2016) (analysen bør utføres på beinmarg)
MDS/MPN
JMML omtales ikke.
Det kreves fravær av BCR-ABL1 fusjonstranskript, rearrangering av PDGFRA/-B eller FGFR1 og PCM1-JAK2 (Arber et al., 2016).
Ved MDS/MPN med ringsideroblaster og trombocytose kreves fravær av (3;3)(q21;q26), inv(3)(q21q26) og del(5q). Det er da aktuelt å undersøke på SFRB1 mutasjon (Arber et al., 2016) og for mutasjon i JAK2 V617F, CALR eller MPL genene.
Dersom man ikke kan stille en sikker diagnose ved mistanke om KMML/aKML med tradisjonelle metoder (inkludert morfologi, flowcytometri og cytogenetikk), kan påvisning av de hyppigst assosierte mutasjonene støtte diagnosen (inkludert hhv. TET2, SRSF2, ASXL1 og SETBP1, samt SETBP1 og ETNK1) (Arber et al., 2016).
Myelomatose
Analysen bør utføres på CD138 celler isolert fra heparin-beinmarg. Standard oppsett tilstrekkelig for prognose og evt behandlingsvalg: FISH t(4;14)/IGH-FGFR3/MMSET, t(11;14)/ IGH-CCND1, del17p13/TP53. Se kapittel 8.7 Cytogenetikk. (St. Olav, Avdeling for patologi og medisinsk genetikk).
Hårcelleleukemi
Analysen bør utføres på benmarg.
BRAF V600E (kun indisert dersom man ikke kommer i mål immunfenotyping og morfologi)
Svarrapport
Rapporten skal inneholde følgende (Hastings et al., 2013):
- Hvilke analyser som er utført og resultatene på disse.
- Ved G-båndsanalyse skrives karyotype i henhold til ISCN nomenklatur 2016 (McGowan-Jordan et al., 2016).
- Antall celler som er analysert
- Ved sekvensering skrives sekvensvarianter ihht HGVS nomenklatur (15.11) (http://varnomen.hgvs.org/)
- Kort beskrivelse av klinisk relevante funn.
- Forhold mellom de enkelte funn og den kliniske problemstilling, evt andre mulig diagnoser (Heim et al., 2015).
- Ved normale resultater ved FISH/PCR analyse må deteksjonsgrense bemerkes (Bustin et al., 2010).
- Eventuelle begrensinger ved analysen eller nødvendige tilleggsanalyser bør bemerkes.
- Dersom det foreligger informasjon om forventet behandlingsrespons eller prognose bør dette også kommenteres, gjerne med prognosegruppe ihht til det gjeldende handlingsprogram.