- Personer med behandlingstrengende hypertensjon i alle aldre opp til 80 år anbefales livsstilstiltak og legemiddelbehandling for å oppnå et stabilt blodtrykk <140/90 mmHg.
- Legemiddelbehandling anbefales hos alle med systolisk BT≥160 mmHg og/eller diastolisk BT≥100, samt ved BT ≥140/90 mmHg når det foreligger påvist organskade og/eller diabetes.
- For å forebygge komplikasjoner anbefales snarlig og stabil blodtrykkskontroll til <140/90 mmHg, mens gevinsten ved å ha lavere blodtrykksmål synes begrenset og ennå uavklart. Behandlingen må tilpasses for å minimalisere bivirkninger.
- Hos eldre over 80 år anbefales et behandlingsmål på <150 mmHg (målområde 140-150 mmHg) for systolisk blodtrykk.
5. Legemidler ved primærforebygging av hjerte- og karsykdom
Når anbefales antihypertensiv behandling?
Behandling av høyt blodtrykk med legemidler vurderes både ut fra blodtrykket, øvrige risikotilstander og total risiko bedømt med NORRISK 2 (se anbefaling om risikovurdering). Ved mild hypertensjon (systolisk BT 140-159 mmHg og diastolisk BT fra 90-99 mmHg) og risiko over den aldersspesifikke tiltaksgrensen, bør endring av levevaner forsøkes først, og effekten bør evalueres i løpet av 3-12 måneder. Individuelt tilpassede råd om livsstilsendringer og evaluering av dette vil ofte øke pasientens mestringsfølelse, motivasjon og deltakelse i behandlingen.
Hovedpunkter i medikamentell blodtrykksbehandling
Det viktigste i blodtrykksbehandlingen er å senke blodtrykket til <140/90 mmHg uten å påføre pasienten bivirkninger. Den forebyggende effekten synes mest relatert til den blodtrykkssenkende effekten per se, og i mindre og usikker grad relatert til valg av legemiddel. De fleste pasienter trenger mer enn ett legemiddel, og man bør derfor gradvis kombinere moderate doser av to (eller tre hvis nødvendig) godt tolererte men ulike legemidler, som tilslutt bør gis i samme kombinasjonspreparat for å øke etterlevelse av behandlingen. Hvis tre legemidler er nødvendig, bør som hovedregel et tiazid-diuretikum inngå som ett av disse, ettersom volumavlastning gjennom økt utskilling av natrium og vann er vesentlig for å oppnå tilstrekkelig blodtrykksreduksjon.
Anbefalte kombinasjoner er beskrevet nedenfor og vist i figur 1 der heltrukne grønne linjer angir anbefalte kombinasjoner.
Kombinasjonen av betablokkere og diuretika anses ikke optimal i primærforebygging, bl.a. grunnet diabetogen effekt, mer bivirkninger og redusert etterlevelse. For personer med afrikansk herkomst ses ofte noe mindre blodtrykkssenkende effekt ved midler som hemmer renin-angiotensinsystemet, slik at kalsiumantagonister og diuretika kan anses som mer naturlige førstevalg.
Dersom en kombinasjon av ovennevnte legemidler ikke gir tilstrekkelig effekt, kan også andre registrerte antihypertensiva brukes. Det gjelder alfa-blokkere (spesielt doxazosin som typisk gis mot benign prostatahyperplasi (prostatisme), aldosteron antagonister (mineral reseptor antagonister, spironolakton, eplerenon), andre kaliumsparende diuretika som amilorid og triamteren samt, direkte vasodilaternde medikamenter (hydralazin, monoxidin) og sentraltvirkende midler (minoxidil, og unntaksvis også avregistrerte, men effektive legemidler som alfa-metyldopa og klonidin, da fortrinnsvis etter vurdering hos spesialist).
Ved oppstart av legemiddelbehandling må man vurdere både blodtrykksnivået, samlet risikostatus, grad av organskade og eventuell annen sykdom inkludert diabetes. Høyt normalt blodtrykk (blodtrykk 130-139/80-89 mmHg) medfører betydelig høyere risiko enn lavere blodtrykk, men det er aldri gjort intervensjonsforsøk hos personer med slike blodtrykk og legemiddelbehandling kan derfor ikke uten videre anbefales. Ved høyt normalt blodtrykk og samtidig organskade, som venstre ventrikkelhypertrofi eller begynnende hjertesvikt, gis behandling ut fra organskaden, i dette tilfelle med ACE-hemmer eller angiotensin reseptor antagonist, som gitt slik organskade har dokumentert effekt på kliniske endepunkter. Påvises typisk kontorhypertensjon («white coat») eller maskert hypertensjon, så bør man forholde seg til det ambulatoriske blodtrykket. Med maskert hypertensjon menes BT <140/90 mm Hg ved kontormåling, men påvist BT>130/80 mmHg ved 24-timers registrering (hele døgnet), eller BT >135/85 mmHg ved hjemmemåling. Både kontorhypertensjon og maskert hypertensjon er vanlige tilstander, som forekommer hos om lag 10% og 15% av den voksne befolkningen, henholdsvis.
I de fleste tilfeller anbefales det å begynne med ett legemiddel i lav dose. I de tilfellene der effekt av lav dose ikke er tilfredsstillende, vurderes bruk av egnede kombinasjoner fremfor maksimal dose av ett enkelt legemiddel for å effektivisere blodtrykksreduksjonen og minimere bivirkningene. Bytt til annet legemiddel eller kombinasjon ved svak respons eller dårlig toleranse. Bruk av langtidsvirkende midler sikrer 24 timers effekt ved éngangsdosering og gjør det samtidig lettere for pasienten å etterleve behandlingen. Ved betydelig forhøyet risiko (og blodtrykk >160/100 mmHg) anbefales å starte med kombinasjonspreparat med lave doser av 2 eller 3 komponenter og gradvis øke doseringen inntil blodtrykket er velkontrollert (2013 Clinical practice guidelines for the management of hypertension in the community. J Hypertens. 2014).
De ulike medikamentgruppene
For detaljert omtale av de spesifikke legemidler vises til preparatomtalen. Følgende betraktninger er ment som generell veiledning.
Angiotensin-konverterende-enzymhemmere (ACE-hemmere) (ATC: C09AA)
Gruppen omfatter korttidsvirkende (kaptopril) og mer langtidsvirkende (enalapril, lisinopril, trandolapril, ramipril) hemmere av angiotensinkonverterende enzym, dvs. omdannelsen av angiotensin I til II. Blodtrykksreduksjonen skyldes dilatasjon av motstandskar på grunn av mindre angiotensin II effekter, mindre aldosteron utslipp og redusert sympatisk tonus. På samme måten som beta-blokkere brukes ACE-hemmere ved flere indikasjoner innen hjertesykdommer. Legemidlene er i blodtrykksbehandlingen særlig effektive i kombinasjon med lavdose tiazid og kalsiumblokker. Enkelte bivirkninger skyldes antakelig samtidig redusert nedbrytning av bradykinin. Irriterende tørrhoste er hyppigste bivirkning og forekommer hos 10-30 % av personer i kontrollerte hypertensjonsstudier. En sjelden bivirkning er angioneurotisk ødem (ansikt, svelg). Nyrefunksjonen bør kontrolleres; 10-20 % stigning i serum kreatinin regnes som fysiologisk, mens pasienten bør utredes mht. nyrearteriestenose eller annen nyreskade/sykdom ved mer betydelig stigning i kreatinin. ACE-hemmer må ikke gis ved planlagt graviditet.
Angiotensin-reseptor-II-antagonister (ATC: C09CA)
Denne legemiddelgruppen har lite bivirkninger og er bedre tolerert enn placebo i mange store studier. I likhet med ACE-hemmere er angiotensin reseptor antagonister spesielt effektive i kombinasjon med lavdose tiazid og er også registrert i kombinasjon med kalsiumantagonist. Blodtrykksreduksjonen skyldes dilatasjon av motstandskar, mindre aldosteron utslipp og redusert sympatisk tonus. Behandling med denne gruppen legemidler forebygger hypertensjonskomplikasjoner, særlig hjerneslag, hos personer med venstre ventrikkel hypertrofi (losartan) og bevarer nyrefunksjonen hos pasienter med diabetisk nefropati (losartan, irbesartan). Reduksjon av kardiovaskulær morbiditet er også vist for pasienter med kjent aterotrombotisk kardiovaskulær sykdom (telmisartan). Angiotensin reseptor antagonister er i studier vist å like effektive som kalsium antagonisten amlodipin hos personer med høy risiko (valsartan), og like effektiv som tiazid diuretika hos eldre (kandesartan). Angiotensin reseptor antagonister synes å gi lavere risiko for utvikling av nye tilfeller med diabetes sammenliknet med ACE-hemmere (Hasvold LP1 m.fl. 2014), og tolereres bedre av personer som får bivirkninger av de sistnevnte. Nyrefunksjonen bør kontrolleres som ved bruk av ACE-hemmer. Angiotensin reseptor antagonister må ikke gis ved planlagt graviditet.
Kalsiumantagonister, som inkluderer Dihydropyridiner (ATC: C08CA) og Verapamil (ATC: C08DA01)
Gruppen består av dihydropyridin-derivater med dokumentasjon på harde endepunkter (amlodipin, nifedipin, felodipin, isradipin) og uten slik dokumentasjon (lerkanidipin), samt verapamil som også har dokumentasjon. Blodtrykksreduksjonen skyldes dilatasjon av motstandskar pga. blokade av kalsium kanaler i glatte muskelceller. Verapamil hemmer overledningen i AV-knuten like mye som betablokkerbehandling og bør derfor ikke kombineres med betablokker pga. faren for AV- blokk og alvorlig synkope. Midlene brukes ofte ved hypertensjon kombinert med takyarytmi (inklusive atrieflimmer). Kalsiumantagonistene oppfattes som nøytrale i forhold til metabolisme, nyrefunksjon og elektrolyttbalansen. Disse egenskapene kan være fordelaktige i varmt klima og ved fare for dehydrering. Dihydropyridin-derivater dilaterer prekapillære arterioler og gir ankelødemer hos 10-30% av pasientene og særlig i høye doser. Verapamil kan medføre obstipasjon. Kalsiumantagonister er effektive mot angina pectoris, men er uegnet ved hjertesvikt og kan forverre systolisk hjertesvikt med lav ejeksjonsfraksjon (med unntak av der det brukes som tilleggsbehandling ved meget alvorlig hypertensjon).
Bruk av kalsiumantagonister som frekvensreduserende middel ved atrieflimmer
Ved venstre ventrikkel hypertrofi av konsentrisk type (tykk hjertemuskel med liten kavitet) komplisert med rask atrieflimmer kan verapamil (Isoptin Retard) være et bedre alternativ enn å bruke Cordarone (amiodarone) ettersom sistnevnte har alvorlige bivirkninger. Slik behandling bør imidlertid kun gis etter vurdering hos spesialist (kardiolog, hypertensjonsspesialist og oftest på sykehus) og EKG må tas regelmessig eller initialt overvåkes kontinuerlig (telemetriovervåkning på sykehus).
Diuretika, som inkluderer Tiazider (ATC: C03A), Furosemid (ATC: C03CA01), Kaliumsparende midler (ATC: C03D)
Gruppen omfatter hydroklortiazid (HCTZ) og andre tiazider, furosemid og kaliumsparende diuretika som amilorid, triamteren og aldosteronantagonister (spironolakton, eplerenon). Furosemid brukes ved alvorlig hjertesvikt med ødemer og ved nyresvikt, men ellers ikke i behandlingen av høyt blodtrykk. HCTZ eller andre tiazider i "lav dose" bør ellers velges som diuretikum i det blodtrykkssenkende regimet; vanlig dose er 12,5 mg eller 25 mg HCTZ, eventuelt i kombinasjon med amilorid, ACE-hemmer, angiotensin reseptor blokker eller kalsiumantagonist. Blodtrykksreduksjonen skyldes initialt natrium- og vannutskillelse, dvs. volumavlastning, men tiazider virker også noe vasodilaterende etter en tid. Større dose tiazider skal ikke brukes rutinemessig på grunn av diabetogen effekt og stor risiko for hypokalemi. Tiazider forebygger først og fremst hjerneslag og hjertesvikt. Forebyggende effekt på koronarsykdom er vist hos eldre og hos personer med type 2-diabetes. Aldosteronantagonist kan være særlig effektivt ved både primær og sekundær hyperaldosteronisme og ved annen alvorlig hypertensjon. Denne medikamentgruppen er veldokumentert ved hjertesvikt, men mangler tilsvarende dokumentasjon på forebygging av komplikasjoner og død ved ordinær hypertensjon. Man må være spesielt forsiktig med aldosteronantagonister hos eldre pasienter, serum-K+ må følges nøye, og redusert nyrefunksjon er relativ kontraindikasjon.
Betablokkere (ATC: C07A)
Gruppen omfatter beta-1 selektive (atenolol, metoprolol, bisoprolol) og ikke-selektive (propranolol, oxprenolol, timolol) blokkere, samt noen substanser som også har alfa-1 blokkerende egenskaper (labetalol, karvedilol). Betablokkere har utstrakt bruk i kardiologien i behandling av pasienter med angina pectoris, takyarytmier, etter gjennomgått hjerteinfarkt og ved hjertesvikt. I meta-analyser for blodtrykksbehandling har beta-blokkere likevel vist noe lavere effekt enn andre dokumenterte legemidler i direkte sammenlikninger, spesielt i forebyggelse av hjerneslag (se ovenfor). Betablokkerne bisoprolol, timolol og karvedilol er ikke undersøkt i hypertensjonsstudier med "harde" kliniske endepunkter. Blodtrykksreduksjonen skyldes redusert hjertearbeid (cardiac output), reninhemming og noe vasodilatasjon særlig ved midler med ledsagende alfa-1 blokade. Betablokkere anbefales ikke som førstevalgspreparat i blodtrykksbehandlingen hos ellers friske personer, men er ofte aktuelt ved samtidig hjertesykdom.
Alfablokkere (ATC: C02CA)
Kun doxazosin er registrert til behandling mot høyt blodtrykk i Norge, men denne og andre alfablokkere er godkjent for behandling av benign prostatahyperplasi (prostatisme). Blodtrykksreduksjonen skyldes dilatasjon av motstandskar pga. blokade av alfa-1 reseptorer som formidler noradrenalins effekter på glatte muskelceller. Forebyggende effekt av doxazosin på harde endepunkter (hjerteinfarkt eller død av koronarsykdom) er dokumentert likeverdig med andre blodtrykksmidler i én studie. I denne studien var legemiddelet imidlertid noe oftere assosiert med forverrelse av hjertesvikt og angina pectoris enn klortalidon, et tiazid-liknende diuretikum (ALLHAT Collaborative Research Group 2000). Doxazosin anbefales derfor ikke brukt som førstevalg eller monoterapi i behandling av personer med høyt blodtrykk. Hos personer med høyt blodtrykk og prostatabesvær kan alfablokkere likevel være et godt valg ved behov for mer enn et legemiddel, men alfablokkere kan relativt ofte gi ortostatisk besvær. Man må være oppmerksom på de vasodilaterende og blodtrykkssenkende effektene ved behandling av benign prostatahyperplasi.
Sentralt virkende antihypertensiva og perifere vasodilatatorer (ATC: C02A, C02DB)
Flere legemidler som egner seg i kombinasjonsbehandling er tilgjengelige og kan brukes ved terapiresistent hypertensjon eller hos personer som ikke tolerer legemiddelgruppene omtalt ovenfor. Slike legemidler har i mindre grad dokumentert effekt på harde endepunkter. Hvis de skal brukes, må det være som supplement til dokumenterte legemidler, som skal brukes som primær- og sekundærvalg. Vurder henvisning til spesialist ved behov for denne type midler.
Viktige tilleggsindikasjoner og noen kontraindikasjoner eller tilstander der man bør vise spesiell forsiktighet
De forskjellige blodtrykkssenkende legemidlene har en rekke tilleggsindikasjoner eller kontraindikasjoner (tabell 1 nedenfor).
| Legemiddelgruppe: | Tilleggsindikasjoner: | Kontraindikasjoner: | Spesiell forsiktighet ved: |
| Diuretika | |||
| – Tiazider | Isolert systolisk hypertensjon Hjertesvikt | Lavt K + Urinsyregikt** | |
| – Furosemid* | Hjertesvikt Nyresvikt (kreatinin >150 µmol/l) | Lavt K + | |
| – Kaliumsparende* | Hjertesvikt, lavt K + | Høyt K +, nyresvikt | |
| Betablokkere | Koronarsykdom Angina pectoris Hjertesvikt Takyarytmi Migrene Glaukom (grønn stær) | Hjerteblokk Dekompensert hjertesvikt | Obstruktiv lungesykdom (ikke-selektiv betablokker) |
| Alfablokkere* | Benign prostatahyperplasi | Ortostatisk hypotensjon | |
| ACE-hemmere | Hjertesvikt Koronarsykdom Diabetisk nefropati | Bilateral nyrearteriestenose Graviditet | Høyt K + |
| Angiotensin reseptor antagonister | Hjertesvikt Diabetes nefropati Venstre ventrikkelhypertrofi | Bilateral nyrearteriestenose Graviditet | Høyt K + |
| Kalsiumantagonister | |||
| – Dihydropyridiner | Isolert systolisk hypertensjon Angina pectoris | Systolisk hjertesvikt | |
| – Verapamil | Angina pectoris Takyarytmi | Hjerteblokk | Systolisk hjertesvikt |
* Anbefales ikke som førstevalg eller monoterapi på grunn av manglende dokumentasjon eller lavere effekt i primærforebygging.
** Bruk av tiazid kan være avgjørende for å oppnå blodtrykkskontroll og kan ev. gis - ved samtidig bruk av tilstrekkelig dosert allopurinol.
Behandling av hypertensjon ved type 2-diabetes
Hypertensjon ved type 2-diabetes bør behandles ved selv lett forhøyede verdier og med noe strengere krav til blodtrykksreduksjon (optimalt < 135/85 mmHg) enn hos personer uten diabetes. Dette er nærmere omtalt i Nasjonal faglig retningslinje for diabetes.
Monoterapi og kombinasjonsbehandling
Behandling kan startes som monoterapi i lav eller moderat dose med påfølgende økning i antall antihypertensiva eller doser, hvis nødvendig. Monoterapi kan være startbehandling ved lav eller moderat samlet kardiovaskulær risiko. Når blodtrykket er ≥160/100 mmHg og samlet risiko høy, anbefales kombinasjon av to antihypertensiva i lav dose som startbehandling. Bruk av kombinasjonsterapi for å oppnå adekvat blodtrykksreduksjon er nødvendig hos mange personer, uavhengig av blodtrykksnivå og av legemiddelklasse. En kombinasjon av tre eller flere legemidler kan være nødvendig. Ved ukomplisert hypertensjon, og hos eldre personer, bør legemiddelbehandlingen normalt trappes opp langsomt. Hos høyrisikopersoner bør opptrapping av behandlingen gjennomføres hurtigere.
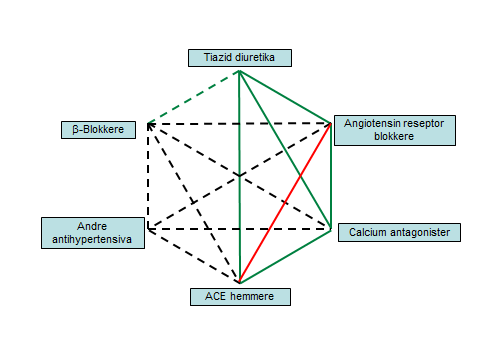
Figur 1. Anbefalte legemiddelkombinasjoner ved behandling av hypertensjon etter 2013 ESH/ESC-retningslinjer og i henhold til dokumentasjon i å forebygge hjerte-karsykdom i store, prospektive, randomiserte, kliniske studier. Heltrukne grønne linjer representerer anbefalte kombinasjoner. Stiplede linjer representerer alternative kombinasjoner. Grønn stiplet linje er i en mellomstilling. Heltrukken rød linje frarådes.
Blodtrykkssenkende legemidler i forskjellige klasser kan kombineres hvis:
- de har forskjellig og supplerende virkningsmekanisme,
- det foreligger dokumentasjon for at den antihypertensive effekten av kombinasjonen er likeverdig eller større enn effekten av det enkelte legemiddel, og
- kombinasjonen har gunstig bivirkningsprofil. Følgende kombinasjoner er funnet å være effektive og vel tolererte:
- Tiazid diuretikum og amilorid (ATC-kode: C03EA01)
- Tiazid diuretikum og ACE-hemmer ( ATC-kode: C09BA)
- Tiazid diuretikum og angiotensin reseptor antagonist ( ATC-kode: C09DA)
- Kalsiumantagonist og ACE-hemmer ( ATC-kode: C09BB)
- Kalsiumantagonist og angiotensin reseptor antagonist ( ATC-kode: C09DB)
- Kalsiumantagonist og tiazid diuretikum ( ATC-kode: C09DX)
Uheldige kombinasjoner kan være betablokkere sammen med kalsiumantagonist av ikke-dihydropyridin-type (verapamil) som sporadisk kan medføre alvorlig atrioventrikulært blokk (hjerteblokk). Kaliumsparende diuretika (amilorid, triamteren, spironolakton, eplerenon) i kombinasjon med ACE-hemmer eller angiotensin reseptor antagonist kan medføre hyperkalemi (kaliumforgiftning), spesielt hos eldre med redusert nyrefunksjon. Kombinasjonen ACE-hemmer og angiotensin reseptor antagonist («dual RAAS blockade») anbefales ikke pga. økt risiko for særlig akutt nyresvikt og hjerneslag, henholdsvis, sammenliknet med placebo i to store studier av pasienter med svært høy risiko (Tobe SW m.fl. 2011).
Hvordan bedre etterlevelsen av behandlingen?
All blodtrykksbehandling må ta utgangspunkt i pasientens egne forventninger, forestillinger og verdivalg. Legen skal imidlertid informere pasienten om risikoen ved hypertensjon og fordelen ved en effektiv behandling. Forskrivende lege bør gjøre seg kjent med pasientens opplevelse av situasjonen før man gir skriftlige og muntlige instruksjoner om behandlingen. Behandlingen må ta hensyn til pasientens behov og livssituasjon. Bruk av kombinasjonspreparater kan forenkle medisineringen for pasienten. I mange tilfeller kan hjemmemåling av blodtrykk være hensiktsmessig, og det er vist at dette øker interessen og bedrer etterlevelsen av behandlingen. Man bør oppfordre pasienten til å leve et normalt og aktivt liv. Legen bør ha stor oppmerksomhet på mulige bivirkninger, og derved kan pasientens tillit til behandlingen bedres.
Det har liten hensikt å forskrive legemidler som ikke blir tatt, og man kan i særlige tilfeller gjøre avtaler om bruk av monitorerings skjema (Morinsky), elektronisk pilleboks, medikamentmålinger i blod eller urin, eller direkte observert legemiddelinntak med etterfølgende 24-timers BT måling. Disse metodene bedrer etterlevelse i studier og kan være hensiktsmessig også i klinisk praksis spesielt ved alvorlig blodtrykksforhøyelse og tilsynelatende manglende effekt av legemidlene.
Blodtrykksmål og reduksjon av totalrisiko
Målet med den antihypertensive behandlingen er å hindre utvikling av hjerte- og karsykdom og endeorganskade. For å oppnå dette, bør blodtrykket senkes <140/90 mmHg. Flere store studer har vist at jo oftere pasienter har slike blodtrykksverdier ved kontroll, eller tilsvarende normalt ambulatorisk blodtrykk, jo mer effektivt forebygges komplikasjonene. I tillegg til adekvat blodtrykksbehandling vil god pasientbehandling også inkludere vurdering av andre risikoreduserende tiltak som statiner og i sjeldnere tilfeller acetylsalicylsyre. Denne vurderingen må gjøres ut fra en totalrisikovurdering (NORRISK2), slik beskrevet i egen anbefaling om risikovurdering. Blodtrykket bør om mulig reduseres til under 140/90 mmHg (systolisk/diastolisk) eller tilsvarende for dagblodtrykk (ambulatorisk, hjemme måling) <135/85mmHg, 24 timers døgnblodtrykk <130/80 mmHg og nattblodtrykk <120/70 mmHg.
Disse måltrykk gjelder for alle hypertensive personer opp til 80 år, men hos de aller eldste kan et systolisk blodtrykk < 150 mmHg være veiledende (i tråd med HYVET studien (Beckett NS m.fl. 2008). Husk kontroll av stående blodtrykk hos eldre og ved diabetes.
Til tross for kombinasjonsbehandling kan det være vanskelig å redusere systolisk blodtrykk til <140 mmHg og enda vanskeligere dersom målet er reduksjon til <130 mmHg. Målblodtrykk <130/80 mmHg er fortsatt et uavklart spørsmål for visse grupper av pasienter med diabetes, nyresykdom, venstre ventrikkel hypertrofi og spesiell risiko for å få hjerneslag. Følgelig er det enklere å oppnå behandlingsmålet dersom blodtrykksbehandlingen initieres før utvikling av betydelig organskade finner sted. Den amerikanske SPRINT studien (SPRINT Research Group, Wright JT Jr m.fl. 2015) viste fordel av blodtrykksmål <120 mmHg, men teknikken for blodtrykksmåling (ikke-observert automatisk kontor måling) er ikke direkte sammenliknbar med vanlige kontormålinger, og resultatene svarer trolig mer til et behandlingsmål på <140 mmHg ved vanlig kontormåling.
På tross av at flere retningslinjedokumenter stiller strenge krav til målblodtrykk for behandling, viser befolkningsstudier at et stort antall personer ikke oppnår slike blodtrykk, selv ikke med bruk av flere blodtrykksmidler. Det kan være flere årsaker til dette. Høyt utgangsblodtrykk og høy alder med isolert systolisk hypertensjon er to vanlige årsaker. Manglende opptitrering av legemidler er en annen viktig årsak. Høyt kontorblodtrykk med normalt ambulatorisk (eller hjemme målt) blodtrykk kan også være en forklaring. Bivirkninger og motvilje mot å bruke mange legemidler kan være medvirkende til at en del pasienter ikke får tilstrekkelig dosert behandling. Klinikeren bør ha målsettinger om å oppnå behandlingsmål hos så mange personer som mulig, men kan likevel formidle til pasienten at betydelig forebyggende effekt kan oppnås selv om man ikke når det tallmessige behandlingsmålet. Andre tiltak, så vel bedring av levevaner som andre typer legemiddelbehandling, kan ha avgjørende betydning for en god håndtering av pasientens risiko.
Store studier med lang oppfølgning av personer behandlet for hypertensjon, har vist at det er viktigere med god kontroll av ambulatorisk blodtrykk enn selve kontorblodtrykket som måles under legekonsultasjonen. Hjemmemåling eller bruk av 24-timers ambulatorisk blodtrykksmåling anbefales spesielt hos personer med svært varierende blodtrykk i kontorsituasjonen, ved bivirkninger eller om det er tvil om målblodtrykk er nådd (vær oppmerksom på at andre grenser gjelder for disse målingene - se egen anbefaling om utredning/kartlegging av hypertensjon).
I startfasen av blodtrykksbehandlingen bør kontrollene være relativt hyppige. Etter stabilisering kan antall kontroller reduseres til 1–2 per år. Personer med høy risiko bør ha hyppigere kontroller. Behandling av hypertensjon bør som oftest være livsvarig. Opphør av behandling fører vanligvis tilbake til en hypertensiv tilstand. Etter langvarig blodtrykkskontroll hos personer med lav risiko kan behandlingen forsøksvis reduseres, spesielt dersom tilfredsstillende livstilstiltak er gjennomført. I noen tilfeller kan også blodtrykknivået være betydelig påvirket av forbigående stressfaktorer. Seponering kan da forsøkes når livssituasjonen er normalisert.
Høyt blodtrykk opptrer hos en stor andel av befolkningen, og utgjør sammen med røyking og høyt kolesterol de viktigste påvirkelige risikofaktorer for hjerte- og karsykdom. Hypertensjon er en særlig viktig årsak til hjerneslag, og er også assosiert med økt risiko for demens. Blodtrykksbehandling med legemidler bidrar sterkt til å redusere insidens av hjerte- og karsykdom og nyresykdom, redusere dødelighet av disse sykdommer og forlenge liv. Dette reduserer behov for legehjelp, sykehus, sykehjem og annen omsorgs- og pleietjeneste. Behandling som igangsettes tidligere i livsløpet har størst relativ effekt (dokumentert for 50-åringer vs. 60 og 70-åringer) mens behandling i høy alder har størst absolutt effekt. De anbefalte blodtrykkssenkende legemidler vil i hovedsak ha lik forebyggende effekt, og valg av legemiddel kan tilpasses individuelt for å minimalisere bivirkninger og for å ta hensyn til andre tilstander som måtte foreligge.
Tallrike kliniske studier og metaanalyser bekrefter at når blodtrykksbehandling igangsettes etter adekvat vurdering av blodtrykksnivå (eventuelt med 24-timers registrering) og øvrige risikofaktorer, vil slik behandling være effektiv og også kostnadseffektiv i et samfunnsperspektiv (Moran AE m.fl. 2014). Internasjonale retningslinjer (2013 ESH/ESC, National Institute for Health and Clinical Excellence 2011, 2013 Clinical practice guidelines for the management of hypertension in the community, An effective approach to high blood pressure control 2014, 2014 Evidence-based guideline for the management of high blood pressure in adults) gir ganske konsistente råd (Kjeldsen S m.fl. 2014) om blodtrykksbehandling, og danner basis for anbefalingene.
Fordeler og ulemper
Fordeler
Blodtrykkskontroll med legemidler forebygger alvorlige komplikasjoner fra hjerne, hjerte, kar- og nyrer, og reduserer dødeligheten. Tilfredsstillende kontroll foreligger ved kontorblodtrykk <140/90 mmHg, tilsvarende dagblodtrykk (ambulatorisk, hjemmemåling) <135/85 mmHg, for 24 timers døgnblodtrykk ved verdier <130/80 mmHg og for nattblodtrykk ved verdier <120/70 mmHg.
Høyt blodtrykk og røyking er de ledende risikofaktorer for global sykdom og død i alle aldre (Turnbull F 2003, Kearney PM m.fl. 2005, Danaei G m.fl. 2009, Sundström J m.fl. 2011, The Global Burden of Disease Study (WHO) 2013 2015). Dette tilsier at en befolkningsrettet strategi er nødvendig for å redusere disse risikofaktorenes betydning for folkehelsen. Blodtrykkets epidemiologi har vært vurdert i en samleanalyse som inkluderte individuelle data på ca. 1 million i utgangspunktet friske personer fulgt i 10-15 år (Turnbull F 2003). Senere analyse av 464.000 pasienter som har vært inkludert i 147 prospektive og randomiserte intervensjonsstudier viste at 55-80 % av hjerteinfarkt og hjerneslag som kan forklares av den foreliggende epidemiologi (Turnbull F 2003), kan forebygges ved blodtrykksbehandling av relativt moderat intensitet (30/15 mmHg reduksjon i blodtrykk) (Law MR m.fl. 2009). Effekten er sterkest med hensyn til å forebygge hjerneslag og relativt sterkest hos middelaldrende (50 åringer) sammenliknet med eldre (70 åringer).
En serie omfattende meta-analyser er publisert om blodtrykksbehandling de siste årene (Sundström J m.fl. 2015, Xie X m.fl. 2015, Ettehad D m.fl. 2015, Thomopoulos C m.fl. 2014; 32: 2285-95, Thomopoulos C m.fl. 2014; 32: 2296-304, Thomopoulos C m.fl. 2014; 32: 2304-14, Thomopoulos C m.fl. 2015; 33: 195-211, Thomopoulos C m.fl. 2015; 33: 1321-41). Noen hovedresultater i disse er som følger:
I placebokontrollerte studier (Thomopoulos C m.fl. 2014) finner man at alle de viktigste hypertensjonsrelaterte komplikasjoner forebygges med følgende relative (%) og absolutte (hendelser per 1000 behandlede) risikoreduksjoner, for 10/5 mmHg reduksjon i blodtrykket og «numbers needed to treat» (NNT) for behandling i 5 år:
- Komplikasjon: Hjerneslag. Relativ risikoreduksjon: 33 %. Absolutt risikoreduksjon: 17. NNT 5 år: 59.
- Komplikasjon: Hjerteinfarkt. Relativ risikoreduksjon: 16 %. Absolutt risikoreduksjon: 7. NNT 5 år: 138.
- Komplikasjon: Hjertesvikt. Relativ risikoreduksjon: 48 %. Absolutt risikoreduksjon: 16. NNT 5 år: 63.
- Komplikasjon: Slag, infarkt og svikt. Relativ risikoreduksjon: 26 %. Absolutt risikoreduksjon: 29. NNT 5 år: 35.
En egen analyse av studier der pasienter ble randomisert til mer intens versus mindre intens blodtrykkssenkende behandling viste først og fremst reduksjon i hjerneslag (-34% og -10 hendelser per 1000, 5-års NNT 98).
Mild hypertensjon
Behandling ved mild hypertensjon og ellers lav kardiovaskulær risiko har beskjeden nytte og har vært rapportert uten effekt én metaanalyser (Diao D m.fl. 2012). I en nyere metaanalyse med større antall pasienter fremkommer imidlertid gunstig effekt (Sundström J m.fl. 2015), slik at behandling med legemidler også må vurderes ved mild hypertensjon, men ut fra at det er økende nytteverdi (lavere NNT) ved økende samlet risiko hos pasienten (Blood Pressure Lowering Treatment Trialists' Collaboration, Sundström J m.fl.2014).
Behandling av pasienter i alle kategorier (Thomopoulos C m.fl. 2014;32: 2296-304), mild hypertensjon (140-159/90-99 mmHg), moderat hypertensjon (160-179/100-109 mmHg) og alvorlig hypertensjon (>180/110 mmHg) forebygger alle komplikasjonene nevnt ovenfor. For pasienter i kategorien mild hypertensjon med generelt lett forhøyet risiko viser en meta-analyse følgende relative (%) og absolutte (1000/5 år) risikoreduksjoner for 10/5 mmHg reduksjon i blodtrykket og NNT for hver enkelt av komplikasjonen for 5 års behandling:
- Komplikasjon: Hjerneslag. Relativ risikoreduksjon: 67 %. Absolutt risikoreduksjon: 21. NNT 5 år: 47.
- Komplikasjon: Hjerteinfarkt. Relativ risikoreduksjon: 32 %. Absolutt risikoreduksjon: 12. NNT 5 år: 86.
- Komplikasjon: Slag eller infarkt. Relativ risikoreduksjon: 49 %. Absolutt risikoreduksjon: 34. NNT 5 år: 29.
- Komplikasjon: Død. Relativ risikoreduksjon: 47 %. Absolutt risikoreduksjon: 19. NNT 5 år: 54.
Meta-analysen viser en fordel av å senke blodtrykket til <130/80 mmHg når det gjelder forebygging av hjerneslag, men ikke for andre endepunkter eller kardiovaskulær død.
Faktisk risikonivå
Når studiene vurderes etter faktisk risikonivå (Thomopoulos C m.fl. 2014; 32: 2304-14) bedømt ut i fra hendelsesrater i kontrollgruppene, lav til moderat, høy, meget høy og svært høy, så er de relative risikoreduksjoner for hendelsene hjerneslag, hjerteinfarkt, hjertesvikt og død ganske like. Dermed vil den absolutte behandlingseffekten (målt ved for eksempel antall reduserte hendelser per 1000 per år) bli høyest i gruppene med høyt risikonivå. Det er derfor grunn til å ha størst oppmerksomhet rettet mot personer med høyest risiko og anbefale flere intervensjoner til denne gruppen. Residualrisiko (gjenværende risiko etter behandling) øker for alle hendelser med økende absolutt risikonivå og med økende alder. Av dette følger at behandling startet i yngre alder vil være gunstigst i forhold til å begrense residualrisiko.
Valg av legemiddel
Alle vanlig brukte blodtrykksenkende legemidler, det vil si forskjellige typer diuretika, beta-blokkere, kalsium antagonister, angiotensin konverterende enzym hemmere, angiotensin reseptor antagonister og sentralt virkende blodtrykkssenkende legemidler, forebygger de forskjellige komplikasjonene og død (Thomopoulos C m.fl. 2015; 33: 195-211). Legemiddel med virkestoffet diltiazem er avregistrert i Norge og tatt ut av anbefalingene. Den forebyggende effekten synes mer relatert til graden av blodtrykksreduksjon enn til type legemiddel.
Sammenlikning av legemidler
En meta-analyse av 50 «head-to-head» (direkte sammenlikning) endepunktstudier viser at de forskjellige legemiddelklassene har nokså lik forebyggende effekt på de forskjellige typer hendelser (Thomopoulos C m.fl. 2015; 33: 1321-41). Dog synes beta-blokkere mindre effektive og kalsium-antagonister mer effektive i å forebygge hjerneslag, og hemmere av renin-angiotensin systemet mest effektive i å forebygge hjertesvikt. Disse effektene er uavhengig av totalt risikonivå, men vurderes å ha betydning for pasienter med spesielt høy risiko for de nevnte enkelthendelser og pasienter med høyt blodtrykk som samtidig lider av disse tilstander.
Ulemper
Blodtrykksbehandling med legemidler kan bidra til sykeliggjøring av personer uten symptomer og er ressurskrevende med tanke på utredning, igangsetting og oppfølging. Behandlingen kan gi både mindre plagsomme bivirkninger og mer alvorlige hendelser som ortostatisk blodtrykksfall med synkope og fall, dessuten kan det ses utløsing eller forverring av nyresvikt.
Uheldig valg av legemidler, kombinasjoner og doser øker risikoen for bivirkninger, og kan resultere i overbehandling. Bivirkninger vil variere betydelig individuelt og i forhold til de ulike legemidlene. Dette er nærmere omtalt i avsnittet praktisk informasjon. Slike ulemper unngås i stor grad ved omsorgsfull oppfølging som tar hensyn til 24-timers blodtrykk, etterlevelse av behandlingen og kjente spesifikke bivirkninger.
Kvalitet på dokumentasjonen
Kvaliteten på dokumentasjonen vurderes som god. Blodtrykksbehandling med legemidler er klart dokumentert i tallrike randomiserte, kontrollerte kliniske forsøk og metaanalyser. Studiene omfatter aktiv behandling versus ingen eller placebobehandling ved mild, moderat og alvorlig hypertensjon, videre sammenlikning av behandling mot ulike målblodtrykk, aktive behandlinger i monoterapi mot kombinasjonsbehandling, samt ulike kombinasjonsbehandlinger mot hverandre.
Verdier og preferanser
Blodtrykksbehandling med legemidler forebygger alvorlige hjerte-, hjerne- og nyresykdommer og forlenger liv. De aktuelle legemidler har generelt lite bivirkninger og kan nesten alltid tilpasses uten vesentlige ulemper.
Det er viktig at leger og annet helsepersonell skaper forståelse for viktigheten av blodtrykksbehandling hos personer som har høy risiko, men som helst vil unngå legemidler. Noen studier indikerer at pasienter ikke ønsker legemidler fordi deres oppfatning om hva som forårsaker det høye blodtrykket ("stress") tilsier at legemiddelbehandling bare skulle være nødvendig for en begrenset periode (Marshall IJ m.fl. 2012).
Observasjoner i store intervensjonsstudier viser imidlertid at pasienter som slutter med legemiddelbehandling av blodtrykk på egen hånd har dårligere prognose. Hos pasienter med lett eller moderat forhøyet risiko for komplikasjoner anbefales imidlertid ikke-farmakologisk behandling som 1. linjebehandling, og ikke-farmakologiske tiltak bør alltid inngå i behandlingen også hos de som trenger legemidler. Nedtrapping og seponering av legemidler kan eventuelt gjøres hvis blodtrykket reduseres klart under behandlingsmålet på stabil dose legemidler, for eksempel gjennom endring av levevaner.
Ressurshensyn
Blodtrykksbehandling krever ressurser både med tanke på utredning, igangsetting og oppfølging, og belaster særlig primærhelsetjenesten. Selve legemiddelkostnadene er imidlertid betydelig redusert i de senere år, og disse kostnadene er ikke lenger vesentlig for ressursbruken.
Kostnad-nytte-analyser viser at om blodtrykksbehandling gjøres etter de rådende retningslinjer, vil tiltaket være kostnadsbesparende (Moran AE m.fl. 2014).
Blodtrykksbehandlingen er mest nyttig ved alvorlig hypertensjon og høy risiko, men også kostnadssparende ved moderat og mild hypertensjon (Moran AE m.fl. 2014).
Beskrivelse av inkluderte studier
Medikamentell blodtrykksbehandling bidrar sterkt til å redusere insidens og dødelighet av hjerte- og karsykdom og nyresykdom.
En serie omfattende meta-analyser er publisert om blodtrykksbehandling de siste årene (Sundström J m.fl. 2015, Xie X m.fl. 2015, Ettehad D m.fl. 2015, Thomopoulos C m.fl. 2014; 32: 2285-95, Thomopoulos C m.fl. 2014; 32: 2296-304, Thomopoulos C m.fl. 2014; 32: 2304-14, Thomopoulos C m.fl. 2015; 33: 195-211, Thomopoulos C m.fl. 2015; 33: 1321-41).
I placebokontrollerte studier (Thomopoulos C m.fl. 2014) finner man at alle de viktigste hypertensjonsrelaterte komplikasjoner forebygges med følgende relative (%) og absolutte (hendelser per 1000 behandlede) risikoreduksjoner, for 10/5 mmHg reduksjon i blodtrykket og «numbers needed to treat» (NNT) for behandling i 5 år:
Komplikasjon; Relativ Risikoreduksjon; Absolutt Risikoreduksjon; NNT 5 år
- Hjerneslag: 33% relativ risikoreduksjon, 17 tilfeller unngått, NNT 59
- Hjerteinfarkt: 16% relativ risikoreduksjon, 7 tilfeller unngått, NNT 138
- Hjertesvikt: 48% relativ risikoreduksjon, 16 tilfeller unngått, NNT 63
- Hjerneslag, hjerteinfarkt og hjertesvikt samlet: 26% relativ risikoreduksjon, 29 tilfeller unngått, NNT 35
- Død: 11% risikoreduksjon, 9 tilfeller unngått, NNT 108
Legemiddelbehandling av høyt blodtrykk reduserer behov for legehjelp, sykehus, sykehjem og annen omsorgs- og pleietjeneste. Behandling som igangsettes tidligere i livsløpet har størst relativ effekt (dokumentert for 50-åringer vs. 60 og 70-åringer) mens behandling i høy alder har størst absolutt effekt. De ulike aspekter ved og effekter av behandlingen er omtalt i tallrike internasjonale retningslinjer, som 2013 ESH/ESC Guidelines for the management of arterial hypertension (2013 ESH/ESC Guidelines, 2013, hoveddokumentasjon).
129. Turnbull F. Blood Pressure Lowering Treatment Trialists' Collaboration. Effects of different blood-pressure-lowering regimens on major cardiovascular events: results of prospectively-designed overviews of randomised trials. Lancet. 2003. 362:. 1527-1535.. https://www.ncbi.nlm.nih.gov/pubmed/14615107.
130. Kearney PM, Whelton M, Reynolds K et al. Global burden of hypertension: analysis of worldwide data. Lancet. 2005. 365. 217-223.
131. Danaei G, Ding EL, Mozaffarian D et al. The preventable causes of death in the United States: comparative risk assessment of dietary, lifestyle, and metabolic risk factors. PLoS Med 6(4): e1000058. doi:10.1371/journal.pmed.1000058. Epub. 2009. Apr 28.
132. Sundström J, Neovius M, Tynelius P, Rasmussen F. Association of blood pressure in late adolescence with subsequent mortality: cohort study of Swedish male conscripts. BMJ. 2011. 342:. d643. https://doi.org/10.1136/bmj.d643.
133. Law MR, Morris JK, Wald NJ. Use of blood pressure lowering drugs in the prevention of cardiovascular disease: meta-analysis of 147 randomized trials in the context of expectations from prospective epidemiological studies. Br Med J. 2009. 338. b1665.
134. Sundström J, Neovius M, Tynelius P, Rasmussen F. Effect of blood pressure reduction in mild hypertension. A systematic review and meta-analysis. Ann Intern Med. 2015. 162:. 184-191..
135. Xie X, Atkins E, Lv J et al. Effects of intensive blood pressure lowering on cardiovascular and renal outcomes: updated systematic review and meta-analysis. . Lancet Online November 6. 2015 http://dx.doi.org/10.1016/S0140-6736(15)01225-8..
136. Ettehad D, Emdin CA, Kiran A et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet Online December 23. 2015. 10.1016/S0140-6736(15)01225-8.
137. Thomopoulos C, Parati G, Zanchetti A. Effects of blood pressure lowering on outcome incidence in hypertension. 1. Overview, meta-analyses, and meta-regression analyses of randomized trials. J Hypertens. 2014. 32:. 2296-2304..
138. Thomopoulos C, Parati G, Zanchetti A. Effects of blood pressure lowering on outcome incidence in hypertension: 2. Effects at different baseline and achieved blood pressure levels-overview and meta-analyses of randomized trials. J Hypertens. 2014. 32:. 2304-2314..
139. Thomopoulos C, Parati G, Zanchetti A. Effects of blood pressure lowering on outcome incidence in hypertension: 3. Effects in patients at different levels of cardiovascular risk-overview and meta-analyses of randomized trials. J Hypertens. 2014. 32:. 2304-2314..
140. Thomopoulos C, Parati G, Zanchetti A. Effects of blood pressure lowering on outcome incidence in hypertension: 4. Effects of various classes of antihypertensive drugs-overview and meta-analyses. J Hypertens. 2015. 33:. 195-211..
141. Thomopoulos C, Parati G, Zanchetti A. Effects of blood pressure-lowering on outcome incidence in hypertension: 5. Head-to-head comparisons of various classes of antihypertensive drugs - overview and meta-analyses. J Hypertens. 2015. 33:. 1321-1341..
142. Marshall IJ, Wolfe CD, McKevitt C. Lay perspectives on hypertension and drug adherence: systematic review of qualitative research. BMJ. 2012 Jul 9;345:e3953. doi: 10.1136/bmj.e3953.
143. Moran AE, Odden MC, Thanataveerat A, et al. Cost-effectiveness of hypertension therapy according to 2014 guidelines. N Engl J Med. 2015. 372:. 447-455..
144. Diao D, Wright JM, Cundiff DK, Gueyffier F. Pharmacotherapy for mild hypertension. Cochrane Database Syst Rev. 2012 Aug 15;8:CD006742. doi: 10.1002/14651858.CD006742.pub2.
145. Blood Pressure Lowering Treatment Trialists' Collaboration, Sundström J, Arima H, Woodward M, et al. Blood pressure-lowering treatment based on cardiovascular risk: a meta-analysis of individual patient data. Lancet. 2014 Aug 16;384(9943):591-8. doi: 10.1016/S0140-6736(14)61212-5.
146. 2013 ESH/ESC Guidelines for the management of arterial hypertension. Eur Heart J. 2013. 34:. 2159-2219..
147. National Institute for Health and Clinical Excellence (NICE) 2011 Hypertension guidelines. http://guidance.nice.org.uk/CG127.
148. 2013 Clinical practice guidelines for the management of hypertension in the community: A statement by the American Society of Hypertension and the International Society of Hypertension (ASH/ISH). J Hypertens. 2014. 32:. 3-15.. 10.1001/jama.2013.284427.
151. Kjeldsen S, Feldman RD, Lisheng L et al. Updated national and international hypertension guidelines: A review of current recommendations. Drugs. 2014. 74. 17. 2033-2051.. 10.1007/s40265-014-0306-5.
152. Hasvold LP, Bodegård J, Thuresson M, et al. Diabetes and CVD risk during angiotensin-converting enzyme inhibitor or angiotensin II receptor blocker treatment in hypertension: a study of 15,990 patients. J Hum Hypertens. 2014 . 11:. 663-9.. 10.1038/jhh.2014.43.
153. Tobe SW, Clase CM, Gao P, et al. ; ONTARGET and TRANSCEND Investigators. Cardiovascular and renal outcomes with telmisartan, ramipril, or both in people at high renal risk: results from the ONTARGET and TRANSCEND studies. Circulation. 2011 Mar 15;123(10):1098-107. doi: 10.1161/CIRCULATIONAHA.110.964171. Epub 2011 Feb 28.
154. SPRINT Research Group, Wright JT Jr, Williamson JD, Whelton PK et al. A Randomized Trial of Intensive versus Standard Blood-Pressure Control. N Engl J Med. 2015 Nov 26;373(22):2103-16. doi: 10.1056/NEJMoa1511939. Epub 2015 Nov 9.
155. Beckett NS, Peters R, Fletcher AE et al. Treatment of hypertension in patients 80 years of age or older. N Engl J Med. 2008. 358:. 1887-1898..
Acetylsalisylsyre (ASA) (eventuelt andre platehemmere ved intoleranse) bør sjelden benyttes i primærforebygging av hjerte- og karsykdommer.
Ved særlig høy risiko og begrensede muligheter for andre forebyggende tiltak, kan slik primærforebygging likevel vurderes etter individuell vurdering av den forventede risikoreduksjon for hjerteinfarkt og hjerneslag, veid opp mot økt blødningsrisiko.
Dersom det unntaksvis anses hensiktsmessig å starte primærforebygging med platehemmer, vil standard behandling med acetylsalisylsyre (ASA) 75 mg daglig (ATC-kode B01A C06) være velegnet (Vandvik PO m.fl. 2012, Lotrionte M m.fl. 2016).
Det er få kontraindikasjoner, bortsett fra allergi.
Ved gastrointestinal sykdom/ulcus sykdom/dyspepsi vil primærforebygging sjelden være aktuelt, men vil unntaksvis kunne brukes forutsatt samtidig behandling med syredempende medikasjon.
Ved intoleranse kan alternativ behandling med klopidogrel 75 mg x 1 (ATC-kode B01A C04) regnes å ha tilsvarende forebyggende effekt og samme blødningsrisiko som ASA.
Bruk av acetylsalicylsyre for primærforebygging av hjerte- og karsykdom har vært anbefalt i mange land tidligere som et rimelig legemiddel med moderat effekt. Nyere studier og metaanalyser viser imidlertid at reduksjonen i kardiovaskulære hendelser er ganske liten, og det ses ingen effekt på dødelighet. Videre vil behandlingen gi økt forekomst av både mindre alvorlige og alvorlige blødninger, og denne uheldige effekten vil være av omtrent samme størrelse som nytte-effekten hos de fleste personer som ikke har manifest hjerte- og karsykdom. Acetylsalicylsyre eller annet tilsvarende platehemmende legemiddel anbefales som hovedregel derfor ikke brukt i primærforebygging, men kan unntaksvis vurderes ved ekstra høy risiko og særlig når ikke andre forebyggende tiltak lar seg gjennomføre på en tilfredsstillende måte.
Fordeler og ulemper
Fordeler
En metaanalyse fra 2015 med 10 randomiserte kontrollerte studier bedømt til å ha moderat til god kvalitet og som til sammen inkluderte 103787 personer, viste at behandling med acetylsalisylsyre (ASA) ga 11 % reduksjon i kardiovaskulære hendelser (hjerteinfarkt, hjerneslag og kardiovaskulær død (relativ risiko (RR) 0,89; 95 % konfidensintervall (KI) 0,84 - 0,95). (Guirguis-Blake JM m.fl. 2015). Effekten skyldtes hovedsakelig en reduksjon av ikke-fatale hjerteinfarkt og koronare hendelser (RR 0,80; 95 % KI 0,72-0,88). Effekt på hjerneslag ble bare sett ved doser <100 mg per dag (RR 0,85; 95 % KI 0,76 - 0,96). Det ble ikke observert noen sikker effekt på kardiovaskulær død eller total dødelighet.
En tidligere metaanalyse fra Antithrombotic Trialists' (ATT) Collaboration (2009) rapporterte om redusert forekomst av kardiovaskulære hendelser (0,51 % per år på ASA mot 0,57% per år på placebo/kontroll, dvs en relativ risikoreduksjon på 12 % (p=0,0001)), men ingen effekt på kardiovaskulær død ((ATT) Collaboration 2009).I en metaanalyse fra 2012 (Vandvik PO m.fl. 2012) ble det påvist noe bedre effekt på hjerteinfarkt (RR 0,77; 95 % KI 0,69-0,86). Det var ingen signifikant effekt på hjerneslag (RR 0,95; 95 % KI 0,85-1,06. Effekten på total dødelighet var grensesignifikant (RR 0,94; 95 % KI 0,88-1,00). Effekten av alternativ platehemmende behandling er langt mindre undersøkt, men synes for klopidogrel å tilsvare ASA (CAPRIE Steering Committee 1996), mens det mangler data for andre platehemmere i primærforebygging.
Ulemper
Behandling med ASA gir økt risiko for blødninger som vil variere med pasientkarakteristika, alder og komorbiditet, og ulike studier har rapportert varierende anslag for blødningsrisikoen.
I førstnevnte metaanalyse rapporterte 9 av de 10 studiene tall for gastrointestinale blødninger, slik at relativ risiko (RR) varierte fra 0,50 til 8,10. En analyse av individuelle data fra denne studien rapporterte en risikoøkning for større gastrointestinale og ekstrakranielle blødninger (RR 1.54; 95 % KI 1.30-1.82) for ASA mot kontroll/placebo (Guirguis-Blake JM m.fl. 2015). Økt risiko for intrakranielle blødninger ble også sett, men med såpass få tilfeller at presise risikoanslag ikke kunne beregnes.
I analysen fra Antithrombotic Trialists' (ATT) Collaboration fant man en økning av gastrointestinale og ekstrakranielle blødninger ved ASA tilsvarende 0,10% per år versus 0,07% per år ved placebo/kontroll, og for hjerneblødning en ikke-signifikant økning tilsvarende 0,04% per år versus 0,03% per år ((ATT) Collaboration 2009). I den sistnevnte analysen medførte ASA-behandling økt risiko for større ekstrakranielle blødninger (RR 1,54; 95 % KI 1,30-1,82) (Vandvik PO m.fl. 2012).
Kvalitet på dokumentasjonen
Kvaliteten på dokumentasjonen vurderes som lav. Flere av studiene er gjort på spesielle grupper personer (kun helsepersonell) og ulike doser og preparater har vært benyttet.
Verdier og preferanser
Behandling med ASA tolereres vanligvis godt. Behandlingen gir likevel en viss økning av alle typer blødninger, inkludert alvorlige gastrointestinale og intrakranielle blødninger. Den økte blødningsrisikoen er i primærforebyggende sammenheng av omtrent samme størrelse som reduksjonen i kardiovaskulære hendelser.
De fleste blødninger vil ha mindre alvorlige langtidskonsekvenser enn tilsvarende tromboemboliske komplikasjoner som f. eks. hjerneslag, men sjeldne tilfeller av fatale hjerneblødninger må også påregnes. Samlet sett vil det vanligvis ikke være hensiktsmessig å bruke ASA i primærforebygging.
Ressurshensyn
Behandling med ASA er rimelig og krever lite oppfølging. Ressurshensyn bør derfor ikke begrense bruken. Klopidogrel som alternativ ved intoleranse for ASA har vært noe mer kostbart, men er likevel å anse som rimelig behandling.
Beskrivelse av inkluderte studier
Det foreligger flere store metaanalyser som viser i hovedsak sammenfallende funn. Primærforebygging med ASA har en beskjeden forebyggende effekt på kardiovaskulære hendelser tilsvarende en relativ risikoreduksjon på ca. 10 %.
Gevinsten beror vesentlig på en reduksjon av ikke-fatale hjerteinfarkt, mens det ikke er sikker effekt vedrørende hjerneslag eller kardiovaskulær dødelighet. Den gunstige effekten må veies mot en liten, men signifikant økt risiko for blødninger.
Vurderingen av den samlede nytten varierer i ulike retningslinjer. Europeiske retningslinjer anbefaler som hovedregel ikke å bruke ASA i primærforebygging (Perk J m.fl. 2012), mens amerikanske retningslinjer har vært mer positive (Guirguis-Blake JM m.fl. 2015, Vandvik PO m.fl. 2012).
Vår anbefaling er at ASA bare unntaksvis bør benyttes for primærforebygging, på linje med de europeiske retningslinjer. I noen tilfeller kan slik primærforebygging likevel synes riktig, særlig når risikoen er ekstra høy, og hvor man har begrenset mulighet til andre forebyggende tiltak. Det anbefales da å gjøre en individuell vurdering av personens risiko, både hva gjelder kardiovaskulære hendelser og blødningsfaren (Nansseu JR m.fl. 2015).
Flere store pågående studier med acetylsalicylsyre i primærforebygging som ventes ferdigstilt innen 2020, og resultatene fra disse kan derfor føre til justering av de nåværende anbefalinger.
156. Antithrombotic Trialists (ATT) Collaboration. Baigent C, Blackwell L, Collins R, et al. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet 2009 May 30;373(9678):1849-1860.
157. CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet.. 1996. 348. 9038. 1329-39..
158. Guirguis-Blake JM, Evans CV, Senger CA et al. Aspirin for the Primary Prevention of Cardiovascular Events: A Systematic Evidence Review for the U.S. Preventive Services Task Force [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US); 2015 Sep. Report No.: 13-05195-EF-1. U.S. Preventive Services Task Force Evidence Syntheses, formerly Systematic Evidence Reviews.
159. Lotrionte M, Biasucci LM, Peruzzi M, et al. Which Aspirin Dose and Preparation Is Best for the Long-Term Prevention of Cardiovascular Disease and Cancer? Evidence From a Systematic Review and Network Meta-Analysis. Prog Cardiovasc Dis. 2016 Feb 4. pii: S0033-0620(16)30009-3. doi: 10.1016/j.pcad.2016.02.001. [Epub ahead of print].
160. Nansseu JR, Noubiap JJ. Aspirin for primary prevention of cardiovascular disease. Thromb J. 2015 Dec 4;13:38. doi: 10.1186/s12959-015-0068-7. eCollection 2015.
161. Perk J, De Backer G, Gohlke H, et al. European guidelines on cardiovascular disease prevention in clinical practice (version 2012). The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Eur Heart J 2012 Jul;33(13):1635-1701. Erratum in: Eur Heart J 2012 Sep;33(17):2126.
162. Vandvik PO, Lincoff AM, Gore JM, Gutterman DD, Sonnenberg FA, Alonso-Coello P, Akl EA, Lansberg MG, Guyatt GH, Spencer FA; American College of Chest Physicians. Primary and secondary prevention of cardiovascular disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012 Feb;141(2 Suppl):e637S-68S. doi: 10.1378/chest.11-2306.
Tilby primærforebygging med statiner til personer <75 år med totalkolesterol > 7,0 mmol/l og LDL-kolesterol > 5,0 mmol/l, (eller LDL-kolesterol > 5 mmol ved lavere totalkolesterol). Dette gjelder ikke kvinner som utvikler slike kolesterolverdier etter overgangsalderen og som ikke har andre risikofaktorer.
Tilby primærforebygging også til personer 45-74 år med totalkolesterol 5,0-7,0 mmol/l (og LDL-kolesterol 3,0-5,0 mmol/l) dersom samlet risiko overstiger de aldersspesifikke risikogrenser.
Statinbehandling bør tilbys personer med høy livstidsrisiko for hjerte- og karsykdom, når kolesterol- og risikonivået er over optimalt nivå. Slik behandling er aktuelt for følgende hovedgrupper:
- Voksne personer med familiær hyperkolesterolemi eller familiær kombinert hyperlipidemi – se eget kapittel om diagnostikk. Behandling av barn med familiær hyperkolesterolemi er en spesialistoppgave.
- Personer ≥ 40 år med diabetes og LDL-kolesterol ≥ 2,5 mmol/l (og yngre pasienter hvis risikoprofilen tilsier det) – se retningslinjer for diabetes.
- Personer < 75 år med totalkolesterol > 7,0 mmol/l og LDL-kolesterol > 5,0 mmol/l, (eller LDL-kolesterol > 5 mmol ved lavere totalkolesterol). Dette gjelder ikke kvinner som utvikler slike kolesterolverdier etter overgangsalderen og med lav samlet risiko (bruk risikoberegning som beskrevet i punktet nedenfor).
- Personer mellom 45-74 år og totalkolesterol 5,0-7,0 mmol/l (tilsvarende LDL-kolesterol på 3,0-5,0 mmol/l) med forhøyet risikoskår for hjerte- og karsykdom. Risikoskår beregnes basert på NORRISK 2 med eventuell justering for tilleggsfaktorer, slik nærmere beskrevet i anbefalingen om Risikovurdering. Som forhøyet risikoskår regnes en estimert risiko tilsvarende:
- ≥ 5 % (45-54 år)
- ≥ 10 % (55-64 år)
- ≥15 % (65-74 år)
- Individuell vurdering foretas hos personer ≥ 75 år (se egen anbefaling).
- Statinbehandling anbefales personer ≥ 45 år med kronisk nyresykdom uansett lipidverdiene (se KDIGO 2013).
- Hos personer < 45 år med betydelig forhøyet risiko sammenliknet med jevnaldrende pga. multiple eller alvorlig risikofaktorer, kan behandling med statiner vurderes også om beregnet 10 års risiko (NORRISK2) er lav. Individuell vurdering foretas og statinbehandling startes der relativ risiko er høy, eksempelvis hos personer med tre eller flere risikofaktorer.
Kolesterolnivå og risikovurdering
Legemiddelbehandling av hyperlipidemi fokuserer på nivået av totalrisiko for hjerte- og karsykdom mer enn på nivået av blodlipider. Enkelte personer med høyt kolesterol har lav absolutt risiko grunnet fravær av andre risikofaktorer for hjerte- og karsykdom, f.eks. postmenopausale kvinner som ikke har påvist høyt kolesterol før menopausen. På den annen side vil personer med gjennomsnittlig eller lavere kolesterolverdi kunne ha klar klinisk gevinst av å benytte lipidsenkende legemidler, eksempelvis personer med sterk familieanamnese, diabetes, inflammatorisk sykdom og kronisk nyresvikt.
Risikotabellene tar hensyn til de viktigste risikofaktorene dvs. alder, kjønn, røykestatus, kolesterolverdi og blodtrykk. Behandleren bør foreta en klinisk vurdering som rommer muligheten for en mer nyansert vurdering, særlig i forhold til betydningen av en persons livsstil og familieanamnese. Mange røykere vil redusere risikoen tilstrekkelig ved røykeslutt uten å trenge lipidsenkende behandling. Ved tidlig hjerte- og karsykdom i slekten (< 60 år hos menn og < 70 år hos kvinner) er det viktig å få frem i hvilken grad dette var forbundet med røyking og uheldig livsstil for å forstå betydningen av de arvelige faktorene i slekten.
Valg av statinpreparat og dose
Det anbefales å starte med 20 mg atorvastatin (ATC-kode, C10A A05) som reduserer LDL-kolesterol anslagsvis med 42 % (Adams SP m.fl. 2015). Dette er i samme effektgruppe (reduksjon 30 - 50 %) som simvastatin 40 mg (ATC-kode, C10A A01), rosuvastatin 10 mg (ATC-kode, C10A A07) , lovastatin 40 mg (ATC-kode, C10A A02) eller fluvastatin depot 80 mg (ATC-kode, C10A A04) . Til sammenlikning gir 10 mg atorvastatin om lag 37 % reduksjon i LDL-kolesterol, mens 40 mg gir om lag 47 % reduksjon. Disse tallene illustrerer at det er lite å hente ved dobling av statindosen når man først har startet med en moderat dose. Ved gjennomsnittlig utgangspunkt av LDL-kolesterol på ca. 4 mmol/l vil en moderat statindose som ovenfor gi en reduksjon i LDL-kolesterol på ca. 1,5 mmol/l.
Hos pasienter med kronisk nyresykdom og GFR < 60 ml/min/1,73 m2, anbefales bruk av preparater og doseringer med lav risiko for interaksjoner (fluvastatin 80 mg, atorvastatin 20 mg, rosuvastatin 10 mg, simvastatin 20 mg, eventuelt i kombinasjon med ezetimib 10 mg (ATC-kode, C10A X09) ). Disse lavere doseringer kan også gjelde ved samtidig bruk av en del antivirale midler. Man bør også være oppmerksom på interaksjoner med flere statiner og andre vanlige legemidler som for eksempel kalsiumantagonister (verapamil) og en rekke antibiotika. Se interaksjoner.no
Behandlingsmål
I primærforebygging mangler det data som gir grunnlag for å anbefale behandling mot en klart definert LDL-kolesterol målverdi. Den absolutte gevinsten ved å tilstrebe lavere verdier er begrenset. Risikoen for utvikling av diabetes øker ved bruk av høye statindoser (Preiss D m.fl. 2011) og nytte-risikobalansen kan tenkes å bli uheldig. Likevel er det grunn til å følge opp effekten av behandlingen for å sikre at tilstrekkelige reduksjoner i LDL-kolesterolnivå oppnås. En reduksjon i LDL-kolesterol på 30-40 % eller en LDL-kolesterol <3,0 mmol/l indikerer betydelig redusert risiko.
Behandlingsmål (LDL-kolesterol < 2,5 mmol/l) anbefales hos pasienter med diabetes på grunn av høy risiko. Hos personer med familiære hyperlipidemier medfører et høyt LDL-kolesterol fra fødselen eller fra ung alder betydelig økning i risiko. Dermed anbefales LDL-kolesterol <2,5 mmol/l generelt hos disse pasientene. Et lavere mål for LDL-kolesterol på < 1,8 mmol/l anbefales ved familiære hyperlipidemier når statinbehandlingen startet først etter 40 år (Nordestgaard BG m.fl. 2013), samt hos slike personer med samtidig påvist hjerte- og karsykdom eller diabetes.
Oppfølging
Ved oppstart av behandling med statiner bør det tas kontrollblodprøver etter 6-12 uker (lipider, transaminaser, eventuelt kreatinin kinase [CK] ved symptomer), og tilsvarende etter 1 år. Dette gjøres for å sikre etterlevelse og kontrollere leverstatus. Det er senere ikke nødvendig å kontrollere lipidene og leverstatus med hyppige rutinekontroller, men dette bør gjøres om pasienten har bivirkninger, man vil følge opp etterlevelsen eller ved endringer i medisineringen.
Hos personer med høy risiko for diabetes bør HbA1C og/eller fastende glukose sjekkes årlig. Risikofaktorer for diabetes inkluderer alder, familiær forekomst av diabetes, metabolsk syndrom (abdominal fedme, hypertriglyseridemi, hypertensjon, økt fastende glukose), visse etnisiteter og bruk av antipsykotika. Vurdering av diabetesrisiko er nærmere beskrevet i Diabetesretningslinjene.
Bivirkninger og toleranse
Økning i leververdier kan forekomme ved statinbehandling spesielt ved høye doser (Desai CS m.fl.2014). Ved økning i transaminaser > 3 ganger øvre normalområdet bør statin stoppes inntil verdiene er tilbake på startnivå. Man kan da prøve en lavere eller annenhver dag dosering, og en gradvis opptitrering. Alkoholinntak øker risikoen for økning i leververdier. En periode på 6-8 uker uten alkohol kan bidra til å normalisere verdiene. Personer med fedme og ikke-alkoholisk fettlever kan også ha økte leververdier som ikke skyldes statinbehandling, og som ikke bør føre til seponering av statin.
Mer vanlig er subjektive plager som gastrointestinalt besvær og stivhet og smerter i muskler og ledd. Muskel- og leddplager rapporteres hos 1-8 % av deltakere i kliniske studier, men forskjellen mellom statin-behandlede og placebo-behandlede deltakere er svært liten (Newman CB m.fl. 2015). I klinisk praksis rapporterer mange flere muskel- og leddsmerter, muskelsvakhet og kramper, stivhet, nedsatt arbeidskapasitet og/eller tretthet enn i randomiserte studier. En betydelig andel av personer med plager tolererer statiner når de tror at de får placebo. Noen personer er bekymret for endringer i hjernefunksjon ved bruk av statiner. Meta-analyser finner ingen sammenheng mellom bruk av statiner og nedsatt kognisjon (Desai CS m.fl.2014). Risikofaktorer for muskel- og leddplager er høy alder, liten kroppsmasse, systemsykdom, polyfarmasi og alkoholmisbruk. Ved slike plager, bør man tenke på underliggende årsaker som viral sykdom, hypotyreose, annen muskelsykdom som polymylagia revmatika og bruk av medikamenter som øker risikoen for muskelplager.
CK måles hos pasienter som rapporterer nye muskelsmerter eller forverring av smerter (Stroes ES m.fl. 2015). Et økt CK-nivå har usikker klinisk betydning i fravær av slike symptomer og bør ikke måles rutinemessig. Statinbehandling bør seponeres dersom CK er 5 ganger eller mer over øvre referanseverdi, og symptomer/verdier vurderes igjen etter noen ukers stopp i behandlingen.
Andre statiner enn atorvastatin kan brukes som alternativer ved bivirkninger, utilstrekkelig effekt eller intoleranse. Ved plagsomme bivirkninger eller utilstrekkelig effekt:
- Midlertidig seponering av statinbehandling, og nytt forsøk når symptomene har gitt seg for å sikre at symptomene er relatert til statinbehandling.
- Dosereduksjon av atorvastatin (doser helt ned til 10 mg eller rosuvastatin 5 mg annen hver dag reduserer LDL-kolesterol nivå effektivt) (Keating AJ m.fl. 2013).
- Bytte til annet statin.
Dersom statiner overhodet ikke tolereres eller lipidnivående på høyeste dose blir liggende vesentlig over behandlingsmål, må tilleggsbehandling med ezetimib vurderes. Ezetimib 10 mg er vist å redusere hendelser hos pasienter med etablert koronarsykdom (Cannon CP m.fl. 2015) og i meta-analyse (Savarese G m.fl. 2015), og kan benyttes i primærprevensjon ved statinintoleranse, eller hos pasienter der man ikke kommer til LDL-kolesterolmål (diabetes, familiære hyperlipidemier). I spesielle tilfeller kan også colesevalam og gallesyrebindende medikamenter (kolestyramin, kolestipol) vurderes.
Nylig er antistoffer mot proprotein-konvertase-subtilisin/kexin-type 9 (PCSK-9-hemmere) registrert i Norge (alirocumab - ATC-kode C10A X14, evolocumab - ATC-kode C10A X13). Ved familiære hyperlipidemier kan slike medikamenter være aktuelle ved manglende lipidkontroll på høyeste tolererte dose statin og ezetimib. Grunnet høye kostnader vil det være begrensninger i forhold til refusjon.
Primærforebygging med statiner har omfattende dokumentasjon på å kunne redusere forekomsten av hjerte- og karsykdom ved ulike nivåer av risiko, samt ved hyperlipidemi, hypertensjon, diabetes og nyresykdom. Gevinsten av behandlingen må likevel veies opp mot risiko for bivirkninger og overbehandling, og i en slik avveining må man både se på lipidverdiene og andre risikofaktorer. Behandlingen har lave kostnader og lav risiko for alvorlige bivirkninger, og vil være kostnadseffektiv når forskrivning gjøres etter en grundig totalvurdering. Behandling er derfor å anbefale når kolesterolnivået overstiger de anbefalte grenser, og bør startes i ung alder ved familiære hyperlipidemier.
Tilsvarende anbefales statiner som primærforebygging til personer mellom 40 og 75 år når risikoen overstiger spesifikke alderjusterte intervensjonsgrenser, samt ved diabetes og nedsatt nyrefunksjon. Slik intervensjon er viktig for å motvirke den betydelige ekstra hjerte- og karrisiko som de sistnevnte tilstander innebærer.
Fordeler og ulemper
Fordeler
Hos personer uten tidligere kardiovaskulær sykdom reduseres vaskulære hendelser (ikke fatalt hjerteinfarkt, koronardød, hjerneslag og revaskularisering) med 25 % per 1,0 mmol/l reduksjon i LDL-kolesterol over 5 år (relativ risiko [RR] 0,75, 95 % konfidensintervall (KI) 0,70-0,80) (Cholesterol Treatment Trialists (CTT) Collaboration 2012). Kardiovaskulær død reduseres med 15 % per 1,0 mmol/l reduksjon LDL-kolesterol over 5 år (RR 0,85, 95 % KI 0,77-0,95) ( CTT Collaboration 2012). Disse effektene er bekreftet i metaanalysen utført av Cochrane-gruppen (Taylor F m.fl. 2013). Relativ-risikoreduksjonen er ikke avhengig av nivået av utgangsrisikoen (CTT Collaboration 2012). Med større reduksjon i LDL-kolesterol oppnås større gevinster (CTT Collaboration 2010). Hos menn og kvinner med lik risiko, er gevinsten ved lipidreduksjon ganske tilsvarende (CTT Collaboration 2015).
Cochrane metaanalysen analyserte data fra 18 studier av statiner i primærforebygging (Taylor F m.fl. 2013). Av disse studiene rekrutterte 14 studier pasienter med risikofaktorer (økning i lipider, diabetes, hypertensjon, mikroalbuminuri). Statinbehandling reduserte totalmortalitet (odds ratio [OR] 0,86, 95 % KI 0,79 - 0,94); kombinert fatal og ikke-fatal hjerte- og karsykdom (RR 0,75, 95 % KI 0,70 – 0,81), kombinert fatal og ikke-fatal koronarsykdom (RR 0,73 (95 % KI 0,67 – 0,80) og fatal- og ikke-fatal hjerneslag (RR 0,78, 95 % KI 0,68 – 0,89). Det var også mindre behov for revaskularisering.
Som en helhet reduserte statiner risikoen for hjerte- og karsykdom med 27 % over 5 år (Taylor F m.fl. 2013). For grupper med median risiko for hjerte-karsykdom på 15 % tilsvarer dette at 50 personer må behandles i 5 år for å spare ett sykdomstilfelle.
Ulemper
Cochrane meta-analysen fant ingen dokumentasjon på at statinbehandling medførte risiko for alvorlige bivirkninger (Taylor F m.fl. 2013). Statinbehandling medfører økt risiko for rabdomyolyse, men dette er såpass sjelden at presise anslag for risikoøkningen ikke kan beregnes. I en stor metaanalyse var statinbehandling assosiert med ca. 9 % økning i risiko for diabetes (Sattar N m.fl. 2010). Statinbehandling av 255 pasienter over 4 år resulterte i 1 ekstra tilfelle med diabetes (Sattar N m.fl. 2010). Høye doser gir større risiko enn lave og moderate doser (Preiss D m.fl. 2011). Blant pasienter med etablert diabetes er det observert en liten økning i HbA1C på 0,12 % (Ergou S m.fl. 2014).
Kvalitet på dokumentasjonen
Kvaliteten på dokumentasjonen vurderes som god, med flere store randomiserte kliniske studier og metaanalyser
Verdier og preferanser
Ut fra dokumentert effekt mot sykelighet og død vil personer med høy risiko for hjerte- og karsykdom ha en forventet egeninteresse av forebyggende behandling, som fremstår som større jo høyere den absolutte risikoen er. For personer som føler seg helt friske og er lite opptatt av fremtidig risiko, kan nytteverdien likevel synes liten, særlig dersom behandling er assosiert med bivirkninger. Det kan være problematisk å gjøre en god avveiing både fordi all risikovurdering er beheftet med usikkerhet, og fordi mange av de vanligste bivirkningene, som muskelsmerter og lette forstyrrelser i mage- og tarmsystemet, er utbredt i befolkningen generelt slik at relasjonen til legemiddelbehandlingen ofte er uklar. Det er viktig at forskrivende lege forsøker å gi balansert og nøktern informasjon om gevinst av behandlingen og hva slags bivirkningsproblemer som er dokumentert, slik at pasienten kan ta stilling til tilbud om forebygging med legemidler på bredest mulig grunnlag.
Ressurshensyn
Legemiddelkostnadene ved behandling med statiner er nå ganske lave, og behøver ikke begrense tiltaket. Derimot vil det være en god del kostnader knyttet til risikovurdering, kontroll og oppfølging som kan beslaglegge mye av primærhelsetjenestens kapasitet. Selv om forebygging av hjerte- og karsykdom må anses som en svært viktig del av helsevesenets oppgaver, må ressursbruken veies mot andre viktige oppgaver og derfor konsentreres om personer som har stor gevinst av forebyggende tiltak. De anbefalte risikovurderinger og intervensjonsgrenser er utarbeidet for å kunne gi en velbegrunnet ressursbruk, og flere studier har vist at primærforbygging med statiner vil være kostnadseffektivt når tiltaket tilbys til pasienter med en beregnet risiko som er tilsvarende (eller til og med lavere) enn det som her er anbefalt som intervensjonsgrenser. (Pandya A m.fl. 2015, Navar-Boggan AM m.fl. 2015).
Beskrivelse av inkluderte studier
Bruk av statiner i primærforebygging er kartlagt i en rekke randomiserte kontrollerte studier og metaanalyser. Vi har vektlagt en Cochrane metaanalyse fra 2013 (Taylor F m.fl. 2013, hoveddokumentasjon). Statinbehandling reduserte totalmortalitet (odds ratio [OR] 0,86, 95 % KI 0,79 - 0,94); kombinert fatal og ikke-fatal hjerte- og karsykdom (RR 0,75, 95 % KI 0,70 – 0,81), kombinert fatal og ikke-fatal koronarsykdom (RR 0,73 (95 % KI 0,67 – 0,80) og fatal- og ikke-fatal hjerneslag (RR 0,78, 95 % KI 0,68 – 0,89). Det var også mindre behov for revaskularisering. Som en helhet reduserte statiner risikoen for hjerte- og karsykdom med 27 % over 5 år (Taylor F m.fl. 2013). For grupper med median risiko for hjerte-karsykdom på 15 % tilsvarer dette at 50 personer må behandles i 5 år for å spare ett sykdomstilfelle. Cochrane meta-analysen fant ingen signifikant økning av alvorlige bivirkninger (Taylor F m.fl. 2013). Statinbehandling kan likevel medføre en meget lav risiko for rabdomyolyse. I en stor metaanalyse var statinbehandling assosiert med ca. 9 % økning i risiko for diabetes (Sattar N m.fl. 2010). Muskelplager av behandlingen er vanlig i klinisk praksis, og dette ses hyppigere ved lav kroppsvekt, høy alder, hos kvinner og ved multifarmasi. Bruk av statiner i primærforebygging bør derfor reserveres for personer med økt risiko og klar gevinst av behandlingen.
163. Adams SP, Tsang M, Wright JM. Lipid-lowering efficacy of atorvastatin. Cochrane Database Syst Rev 2015; 3: CD008226.
164. Cannon CP, Blazing MA, Guigliano RP, et al. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015; 372: 2387-2397.
165. Cholesterol Treatment Trialists (CTT) Collaboration. Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, Peto R, Barnes EH, Keech A, Simes J, Collins R. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010; 376: 1670-1681.
166. Cholesterol Treatment Trialists (CTT) Collaboration. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet 2012; 380: 581-590.
167. Cholesterol Treatment Trialists (CTT) Collaboration. Efficacy and safety of LDL-lowering therapy among men and women: meta-analysis of individual data from 174 000 participants in 27 randomised trials. Lancet 2015; 385: 1397-1340.
168. Desai CS, Martin SS, Blumenthal RS. Non-cardiovascular effects associated with statins. BMJ 2014; 349:g3743.
169. Ergou S, Lee CC, Adler AI. Statins and glycaemic control in indivdiuals with diabetes: a systematic review and meta-analysis. Diabetologia 2014; 57: 2444-2452.
170. KDIGO Clinical Practice Guidelines for lipid management in chronic kidney disease. Kidney Int Suppl 2013; 3.
171. Keating AJ, Campbell KB, Guyton JR. Intermittent nondaily dosing strategies in patients with previous statin-induced myopathy. Ann Pharmacother 2013; 47: 398-404.
172. Newman CB, Tobert JA. Statin intolerance. Reconciling clinical trials and clinical experience. JAMA 2015; 313: 1011-1012.
173. Nordestgaard BG, Chapman MJ, Humphries SE, et al. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease. Consensus statement of the European Atherosclerosis Society. Eur Heart J 2013; 34: 3478-90.
174. Preiss D, Seshasai ST, WelshP, et al. Risk of incident diabetes with intensive-dose compared with moderate-dose statin therapy: a meta-analysis. JAMA 2011; 305: 2556-2564.
175. Sattar N, Preiss D, Murray HM, et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomised statin trials. Lancet 2010; 375: 735-742.
176. Savarese G, De Ferrari GJ, Rosano GM, et al. Safety and efficacy of ezetimibe: a meta-analysis. Int J Cardiol 2015; 201: 247-252.
177. Stroes ES, Thompson PD, Corsini A, et al. Statin-associated muscle symptoms: impact on statin therapy – European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management. Eur Heart J 2015; 36: 1012-1022.
178. Taylor F, Huffman MD, Maceo AF, et al. Statins for the primary prevention of cardiovascular disease. Cochrane Database Syst Rev 2013; 1: CD004816.
Siste faglige endring: 05. desember 2024