Bakgrunn
Høsten 2014 fikk Helsedirektoratet og Direktoratet for medisinske produkter (DMP) i oppdrag fra Helse- og omsorgsdepartementet å utarbeide forslag til ordning for beredskapssikring av legemidler for primærhelsetjenesten.
Helsedirektoratet foretok i 2011 – 2012 en gjennomgang av nasjonal legemiddelberedskap (Rapport IS-1993). Det ble da foreslått at Helseforetakene skulle ha ansvaret for beredskapssikring av egne legemidler («desentralisert modell»). Legemidler som forskrives i primærhelsetjenesten ble foreslått beredskapssikret via lagerhold hos legemiddelgrossist («grossistmodell»). For detaljer vises det til Rapport IS-1993.
Helsedirektoratet og DMP foreslo, basert på Helsedirektoratets anbefaling fra Rapport IS-1993, å forankre plikten til å beredskapssikre legemidler som brukes i primærhelsetjenesten hos legemiddelgrossist.
Helse- og omsorgsdepartementet vedtok, som følge av forslaget, en plikt for legemiddelgrossister som omsetter legemidler til apotek til å beredskapssikre et ekstra lager av legemidler. Jf. forskrift 21. desember 1993 nr. 1219 om grossistvirksomhet med legemidler (grossistforskriften) § 5. Forskriften regulerer hvilke legemidler og hvilket volum av disse som omfattes av beredskapsplikten. Det ble også vedtatt å øke apotekets maksimale innkjøpspris med 1 pst for å kompensere grossistenes økte kostnader ved beredskapslagerholdet. Jf. forskrift 18. desember 2009 nr. 1839 om legemidler (legemiddelforskriften) § 12-2.
Den nye beredskapsordningen trådte i kraft 1. januar 2016.
Oppfølging av plikt til beredskapslager hos grossist
DMP har, etter innføringen av den nye beredskapsordningen 1. januar 2016, fulgt opp grossistenes overholdelse av plikten til å holde beredskapslager på ulike måter. Det er gjennomført stikkprøvebasert tilsyn med de tre apotekgrossistene Norsk Medisinaldepot AS (NMD), Apotek 1 Gruppen AS (Apotek 1) og Alliance Healthcare Norge AS (AHN) i mai 2016 og februar 2017 og ordinært tilsyn hos én av grossistene i 2018.
Stikkprøvebasert tilsyn mai 2016
I mai 2016 innhentet DMP følgende opplysninger om legemidler omfattet av kravet om beredskapsplikt fra de tre apotekgrossistene:
- Total omsetning for 2015, inkludert eventuell eksport, fordelt per måned.
- Total omsetning for årets tre første måneder, fordelt per måned og ulike kundegrupper (inkl. eventuelle eksportkunder).
- Lagerbeholdning (antall pakninger) per 1. februar, 1. mars og 1. april 2016.
Gjennomgangen av den innsendte dokumentasjonen viste at totalbeholdningen av legemidlene omfattet av beredskapsplikten i Norge hadde økt, men det var forskjeller mellom grossistene i hvor langt de hadde kommet. Gjennomsnittsbeholdningen av beredskapslegemidlene i Norge totalt sett hadde økt, men for en god del av legemidlene var beredskapslagerbeholdningen under 2 måneders omsetning. Ca. 6 % av grossistenes totalomsetning av legemidlene som var omfattet av ordningen, var eksportert. Det innebærer at det også ble eksportert legemidler i oppbyggingsfasen av beredskapslagrene. Man kunne imidlertid ikke se at eksporten gikk utover beredskapsnivået. På bakgrunn av dette konkluderte Legemiddelverket med at ordningen så ut til å være hensiktsmessig innrettet.
Stikkprøvebasert tilsyn februar 2017 (siste halvår 2016)
I januar 2017 ba DMP på nytt om blant annet følgende opplysninger om legemidlene omfattet av beredskapsplikt fra apotekgrossistene:
- Omsetning per måned i perioden 1.7.2016 - 31.12.2016; totalomsetning og omsetning fordelt på ulike kundegrupper (inkl. eksport; i antall pakninger)
- Lagerbeholdning (i antall pakninger) per 1. i måneden for hver måned i perioden 1.7.2016 - 31.12.2016 (totalbeholdning i alle grossistens lokaliteter).
- Uttalelse på de varenumrene som i perioden 01.11.2016 – 31.12.2016 hadde hatt en gjennomsnittsbeholdning på under 2 måneder av gjennomsnittlig omsetning i perioden 01.01.2016 - 31.12.2016.
Hensikten bak ordningen (herunder finansieringen) med økt beredskap, var at grossistene skulle ha et økt lager tilsvarende to måneders omsetning (Høringsnotat av 7. mai 2015), mens oppfatningen blant grossistene synes å være at lagerbeholdningen totalt sett skal tilsvare 2 måneders omsetning.
Gjennomgangen av den innsendte dokumentasjonen viste at selv om det i Norge totalt var en gjennomsnittsbeholdning på ca. 1,8 måneders lager, var det flere legemidler som hadde under to måneder lagerbeholdning, sammenlignet med forrige datainnsamling. Det fremgikk også at det foregikk eksport på enkelte legemidler uten at målet om to måneders lager var nådd.
DMP hadde også bedt grossistene om å kommentere avvik fra beredskapslager tilsvarende to måneders omsetning, der det ikke var oppfylt. Variasjon i salg, opptrapping av lager av ny vare og kvotering fra leverandør var årsakene som gjennomgående ble oppgitt som forklaring.
Vi ser av datagrunnlaget at til tross for at beredskapen er bedre enn før ordningen ble innført, har grossistene fremdeles ikke oppnådd ønsket lagernivå for et betydelig antall legemidler.
Ordinært tilsyn hos grossist
Det er i henhold til legemiddelregelverket i EU og norsk regelverk, krav om at myndighetene fører tilsyn med virksomheter som driver grossistvirksomhet minimum hvert 5. år, eller oftere om risikovurdering tilsier det. DMP har gjennomført ett ordinært tilsyn hos en grossist som er omfattet av beredskapsordningen, etter innføringen ved årsskiftet 2015/2016. Tilsynet viste at grossisten har rutiner for å følge opp om beredskapslageret på plass, men at de ønsker nærmere veiledning for hvordan de skal fastsette størrelsen på beredskapslageret. Det vil si informasjon om hvilken omsetningsperiode som bør ligge til grunn for beregningene og hvor ofte den beregnede størrelsen på beredskapslageret bør oppdateres.
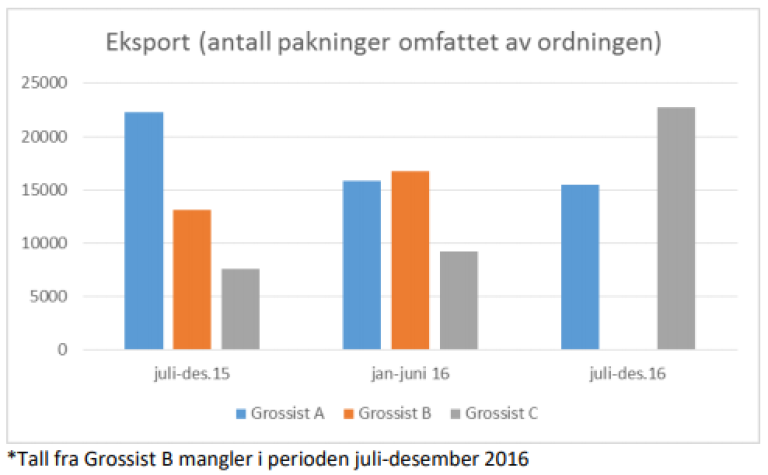
Informasjonen fra stikkprøvetilsynene i 2016 og tilsynet hos grossist, tyder på en klar sammenheng mellom eksport hos grossist og leverandørenes kvotering for alle grossister i etterkant. Dette ser vi særlig hos en leverandør som har flere legemidler på beredskapslisten. Vi ser at kvotering skjer mot hele markedet i etterkant av at en grossist har eksportert, fordi leverandøren sammenlikner omsetningstall mot mengden de har levert til det norske markedet. Leverandøren mener at de har levert nok pakninger til å dekke både oppbygning av beredskapslager i 2016 og ordinær omsetning i markedet.
Anbefalinger
Ut i fra DMPs tilsynserfaringer med overholdelse av kravet om beredskapslager hos grossist, anbefaler vi at man gjør flere tiltak for å sikre tilstrekkelig stort beredskapslager i Norge. Tiltakene innbefatter å utarbeide veiledning til grossistene, stikkprøvetilsyn og endringer i grossistforskriften.
Veiledning til grossistene og videre oppfølging
Vi anbefaler at DMP utarbeider kortfattet veiledning for hvordan grossistene skal følge opp kravet i forskriften. Veiledningen må gi informasjon om hvordan grossistene skal beregne hvor stort beredskapslageret skal være, hvor ofte de skal oppdateres og tydeliggjøre at beredskapslageret skal komme i tillegg til grossistens normale lagernivå. DMP må i veiledningen ta stilling til eventuelle midlertidige unntaksordninger ved inn- og utfasing av varer. Aktørene vil få anledning til å gi innspill til veilederen før den publiseres. Det bør gjennomføres stikkprøvetilsyn hos grossistene en tid etter veiledningen er publisert, for å sjekke om de følger de nye retningslinjene og se om de har tilsiktet effekt.
Endringer i grossistforskriften
Eksport
På sikt bør DMP sammen med Helse og omsorgsdepartementet vurdere om man må gjøre endringer i grossistforskriften med hensyn til eksport av legemidler omfattet av beredskapsordningen. Dette gjelder spesielt i oppbygningsfasen av beredskapslager, etter at et produkt har kommet på markedet/får refusjon, slik at man sikrer at leverandørene er trygge på at legemidlene de leverer går til oppbygging av beredskapslager og ikke eksporteres til andre markeder.
H-reseptlegemidler
Det bør vurderes om det er hensiktsmessig at legemidler som er overført til H-reseptordningen skal tas ut av listen over legemidler som skal omfattes av kravet om beredskapslager, jf. § 5 i grossistforskriften. Ordningen er ment å sikre beredskap for legemidler som benyttes i primærhelsetjenesten og ikke spesialisthelsetjenesten. Det er helseforetakene som har finansieringsansvar for legemidler i spesialisthelsetjenesten og det kan derfor være mer hensiktsmessig at legemidlene beredskapssikres gjennom avtalene som inngås mellom grossist og Sykehusinnkjøp HF.
I tillegg settes innkjøp av legemidler til H-reseptordningen jevnlig ut på anbud. I praksis vil man kunne forvente store utfordringer med å sikre 2 måneders beredskapslager i overgangsperiodene mellom anbudene, for den eller de grossistene som har avtale med Sykehusinnkjøp HF om distribusjon av legemidlene.
System for oppdatering av listen over beredskapslegemidler
Per i dag er det ikke noe system for jevnlig oppdatering av listen over beredskapslegemidler. Det er heller ikke klart for DMP hvilken etat som har fått delegert ansvaret for listen. Det bør derfor klargjøres hvem som har ansvar, og opprettes et system eller rutiner for jevnlig oppdatering. Dette innebærer at man også må fastsette hvor ofte listen skal oppdateres og hvem som skal foreta vurderingen på hvilke legemidler som skal stå på listen. Vi ser det som naturlig at representanter både fra DMP og Helsedirektoratet bør bidra i dette arbeidet. Listen er et vedlegg til grossistforskriften og man kan tenker seg en løsning i retning av slik det gjøres med byttelisten. Det vil være naturlig for grossistene at veiledning og listen over inkluderte legemidler på pakningsnivå finnes på samme sted.
Meldeplikt ved mangel
I dag opplever grossistene innimellom at de ikke får levert tilstrekkelig mengde legemiddel til å fylle opp beredskapslageret i tillegg til det normale omsetningslageret. Det bør vurderes om grossistene bør få plikt til å melde til DMP i de tilfellene grossist ikke klarer å oppfylle beredskapsforpliktelsen. En slik meldeplikt bør ikke omfatte situasjoner der man for en kort periode benytter seg av beredskapslageret, men mer langvarige situasjoner der de ikke klarer å fylle opp lageret. Meldeplikten behøver heller ikke omfatte pågående legemiddelmangler (som er angitt på DMPs hjemmesider).