Preoperativ forberedelse og utredning
Informasjon gis av opererende kirurg og skal omfatte sykdom, utbredelse, forestående operasjon og komplikasjonsrisiko. Skriftlig informasjon bør gis i tillegg. Det skal journalføres at informasjonen er gitt og at pasienten har gitt sitt informerte samtykke.
Før operasjonen bør minimum TSH, s-calcium og 25-hydroxyvitamin D bestemmes og evt s-calcitonin.
Alle pasientene bør preoperativt undersøkes med ultralyd av operatøren eller med operatør tilstede.
Preoperativ laryngoskopi er obligatorisk. Pasienter med rekurrensparese kontralateralt til den aktuelle operasjonssiden bør henvises til sentere med spesiell erfaring, og kirurgi bør utføres ved hjelp av nervemonitorering.
Ved mistanke om innvekst i trachea eller metastaser i mediastinum, må det gjøres MR-/CT undersøkelse, eventuelt med tillegg av endoskopi i trachea og øsofagus.
Røntgen columna med fleksjon og ekstensjon for å avsløre atlanto-occipital subluksasjon hos pasienter med rheumatoid artritt kan gi grunnlag for spesielle hensyn ved leie på operasjonsbordet.
Tromboseprofylakse er diskutabelt, men kan gis ved spesielle indikasjoner (for eksempel ved operasjonstid > 120 minutter, eller høyrisiko pasienter med trombofili).
Antibiotikaprofylakse gis ikke rutinemessig. Den kan likevel vurderes ved større residivoperasjoner, perforasjon til mucosa og/eller lang operasjonstid (>4–5 timer).
Medikamentell forbehandling før operasjon
Det er ingen evidens for spesiell preoperativ behandling bortsett fra at pasienter med hyperthyreose bør få thyrostatisk behandling.
Med hensyn til postoperativ hypokalsemi og hyppig vitamin D mangel i Norge kan preoperativ normalisering av vitamin D vurderes.
Calcium og vitamin D mangel korrigeres med tilskudd av calcium kombinert med vitamin D3 (for eksempel 800 IU vitamin og calcium 1000 mg) over flere dager. Ved alvorlig vitamin D mangel (<30 nmol/L) bør det gis ekstra tilskudd med vitamin D (for eksempel kolekalsiferol 100.000 IU (Detremin 5 ml i løpet av 1 dag, eventuelt fordelt på to doser).
Ved kjent lav serum-magnesium (<0,70 mmol/L) kan det gis tilskudd med magnesium 120 mg x 3 over noen dager. Dersom det er mistanke om alvorlig magnesium-mangel, kan en vurdere å gi magnesium intravenøst (MgSO4 eller MgCl 10–30 mmol i 1000 ml NaCl over 6 timer dersom normal nyrefunksjon).
Kirurgi ved differensiert thyroideacarcinom
Ved DTC bør omfanget av operasjonen avgjøres i forhold til behandlingsgruppene (gruppe 1–3) som baseres på resultatene av preoperativ utredning. Ved behandlingsgruppene 1 og 3 er det god konsensus med hensyn til kirurgisk behandling, mens det i gruppe 2 til en viss grad kan foretas en individuell avgjørelse, særlig med hensyn til profylaktisk sentral lymfeknutedisseksjon.
Indikasjon for radiojodterapi og TSH supprimerende behandling baseres derimot på informasjon etter histologisk undersøkelse og undersøkelser i forbindelse med radiojodterapi (helkroppsscan og s-Tg).
Som behandlingsgruppe 1 eller lavrisiko differensiert thyroideacarcinom regnes:
- Solitært intrathyroidalt papillært thyroideacarcinom ≤10 mm uten lymfeknutemetastaser
- Minimalt-invasivt follikulært thyroideacarcinom ≤40 mm uten karinvasjon og uten lymfeknutemetastaser
Papillært mikrocarcinom
Papillært mikrocarcinom (mikro-PTC) defineres basert kun på diameter (papillært thyroideacarcinom ≤10 mm). Det må ikke forveksles med lavrisiko papillært thyroideacarcinom.
Prevalens av mikro-PTC ved autopsi er ca. 5 %, men i enkelte arbeider opp til 35 %. Franske studier har vist at mikro-PTC som årsak til operasjon for thyroideacarcinom har økt fra 13 % i 1980 til 37 % i år 2000, noe som tas som uttrykk for bedre diagnostikk (ultralyd).
Papillært carcinom ≤10 mm kan ha:
- Ekstrathyroidal utbredelse (15 til 44 %)
- Multifokalitet (28 til 43 %)
- Bilateral utbredelse (16 til 25 %)
- Lymfeknutemetastaser (19 til 50 %)
Etter kirurgisk behandling av mikro-PTC er sykdomsspesifikk mortalitet <2 % inntil 30 år. Lokalresidivrisiko etter hemithyroidektomi er ca. 20 %, etter total thyroidektomi ca. 5 %. Risikofaktorer for residiv er multifokal og bilateral forekomst, ekstrathyroidal vekst av primærtumor, klinisk lymfeknuteaffeksjon, histologitype og operasjonsomfang.
Ved profylaktisk lymfeknutedisseksjon er det påvist lymfeknutemetastaser ved mikro-PTC hos opp til 61 %. Det er imidlertid ikke sikre holdepunkter for at profylaktisk lymfeknutedisseksjon har betydning for langtidsprognosen. Rapporterte behandlingsopplegg varierer fra observasjon alene til total thyroidektomi og radiojod.
1. Lavrisiko mikro-PTC
Det er holdepunkter for at «lavrisiko» mikro-PTC (negativ familieanamnese for thyroideacarcinom, ikke tidligere strålebehandling, ikke lymfeknutemetastaser, unifokal, intrathyroidal tumor) til og med kan observeres uten operasjon.
I Norge anbefales det foreløpig i slike situasjoner fortsatt hemithyroidektomi. Ved istmuscarcinom kan en istmusreseksjon anses som tilstrekkelig. Det er ingen indikasjon for radiojod eller TSH supprimerende behandling.
2. Ikke lavrisiko mikro-PTC
De øvrige mikro-PTC behandles som papillære cancere generelt. Dersom mikro-PTC blir funnet tilfeldig i et operasjonspreparat er kompletterende total thyroidektomi indisert hvis det påvises ekstrathyroidal vekst, multifokalitet eller lymfeknutemetastaser.
Reseksjonsomfang thyroidea
Følgende begreper skal brukes:
- Hemithyroidektomi: komplett fjerning av en thyroidealapp inkludert isthmus og lobus pyramidalis
- Nesten-total hemithyroidektomi: hemithyroidektomi hvor maks. 1g thyroideavev er igjen
- Total thyroidektomi: fjerning av begge thyroidealapper, isthmus og lobus pyramidalis.
Nesten-total hemithyroidektomi kan være indisert ved vanskelige disseksjonsforhold paratrachealt for å beskytte nervus recurrens og/eller parathyroideakjertel.
Hvis det ikke gjøres total thyroidektomi/hemithyroidektomi, skal kirurgen nøyaktig beskrive omfanget av reseksjonen av hver lapp (begrepene subtotal lobektomi og subtotal thyroidektomi er upresise og skal unngås).
Papillært thyroideacarcinom
Total thyroidektomi utføres hvis minst en av følgende faktorer er til stede:
- Tumor med diameter større enn 1 cm *
- Multifokal sykdom
- Gjennomvekst av thyroideakapsel
- Forekomst av metastaser (lokale, regionale eller fjern-)
- Tidligere bestrålt hals
- Familiær thyroideacarcinom
Kirurgi i en seanse bør tilstrebes. BRAF analyse ved FNC kan være av nytte siden BRAF mutasjonen sterkt assosieres med papillære cancere.
Hemithyroidektomi kan være aktuelt hvis alle følgende faktorer er oppfylt:
- Tumor med diameter ≤ 1 cm *
- Ikke tidligere bestråling av halsen
- Unifokal sykdom
- Ikke gjennomvekst av thyroideakapsel
- Ikke metastaser
- Ikke holdepunkter for familiært carcinom
* ATA 2015 og BTA 2014 åpner for hemithyroidectomi ved < 4 cm) (DATHYRCA < 2 cm) uten andre risiki.
En bør være klar over at en del av disse kriteriene vanligvis vil kunne bestemmes kun på histologipreparat – altså postoperativt. Ved knuter ≤10 mm på ultralyd som blir funnet som PTC ved FNC (mikro-PTC) bør en være bevisst på at det ikke nødvendigvis foreligger «lavrisiko» mikro-PTC.
Ved mistanke om noen av de nevnte risikofaktorene bør en total thyroidektomi vurderes. Alternativt kan en hemithyroidektomi utføres, men pasientene bør informeres om at det kan bli nødvendig å utføre en kompletterende thyroidektomi på et senere tidspunkt.
Follikulært thyroideacarcinom
FNC kan ikke skille mellom follikulære adenomer og carcinomer. Det samme gjelder vanligvis for frysesnitt. Hvis samlet vurdering av all diagnostisk informasjon indikerer follikulær neoplasi, skal det utføres diagnostisk hemithyroidektomi. Ved tegn til gjennomvekst av thyroideakapselen bør total thyroidektomi overveies i same seanse, spesielt hos eldre. Total thyroidektomi krever at pasienten er forberedt på og har akseptert muligheten.
Hvis endelig histologisk diagnose bekrefter at det foreligger follikulært adenom, er pasienten ferdigbehandlet.
Hvis endelig histologisk diagnose bekrefter at det foreligger FTC er videre behandling avhengig av utført primæroperasjon, tumordiagnose og tumordiameter.
Etter kun unilateral utført thyroidektomi er det aktuelt med kompletterende total thyroidektomi hvis det foreligger minst en av følgende faktorer:
- FTC med utbredt invasivitet eller karinvasjon
- Minimalt invasiv FTC med diameter > 4 cm
- Oxyfilt (Hürthle-celle) carcinom
Hemithyroidektomi kan anses som tilstrekkelig hvis ingen av disse faktorene er tilstede.
Lite differensiert thyroideacarcinom
Ved lite differensiert thyroideacarcinom (PDTC) bør det utføres total thyroidektomi. Hos høyrisiko-pasienter (for eksempel høy alder, recurrensparese på tumorsiden) kan det ved unilateral tumor unntaksvis vurderes å utføre kun en hemithyroidektomi.
Disseksjon av lymfeknuter
Regionale lymfeknutemetastaser kan være tilstede på diagnosetidspunktet i 20–90 % ved papillære carcinomer. Dette medfører at pasienter med påvist thyroideacarcinom alltid bør få undersøkt hele halsen med ultralyd preoperativt.
Noen studier rapporterer at lymfeknutemetastaser ikke har klinisk relevans for lavrisikopasienter. «Surveillance, Epidemiology, and End Result (SEER) database» fant imidlertid at blant 9904 pasienter med PTC ville lymfeknutemetastaser, alder >45 år, fjernmetastaser og stor tumor, signifikant predikere dårligere prognose ved multivariat analyse. 14-års overlevelse uten lymfeknutemetastaser var 82 %, og med lymfeknutemetastaser 79 % (p<0.05). En annen SEER studie konkluderte med at cervicale lymfeknutemetastaser medførte en uavhengig risiko for redusert overlevelse, men bare hos pasienter med follikulært carcinom og alder over 45 år.
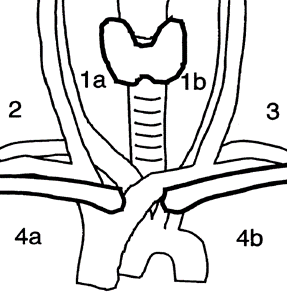
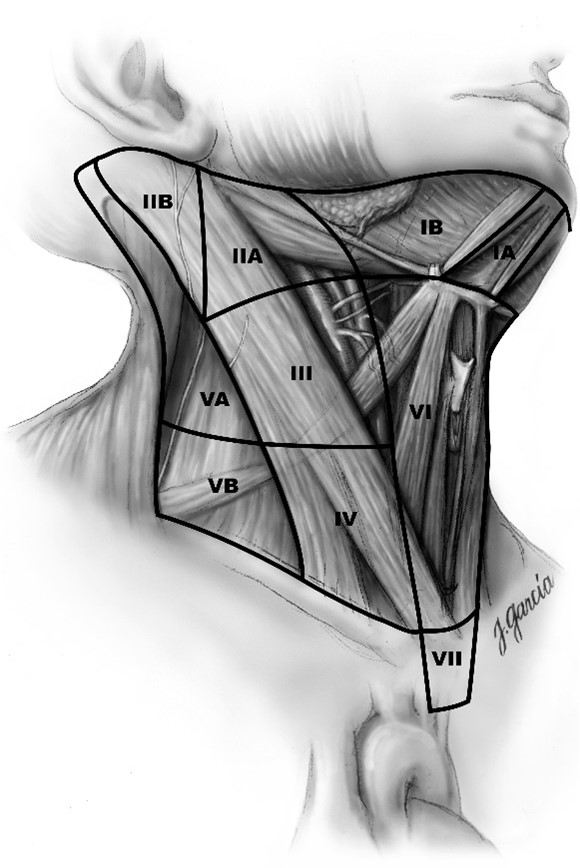
De regionale lymfeknutene omfatter det sentrale kompartment, de laterale cervikale og de øvre mediastinale lymfeknutene. Disse kan beskrives med UICC (Robbins) system eller med Dralles kompartmentsystem:
(Tabell 5, Bilde 1):
- Kompartmentsystem (Dralle) med et sentralt, to laterale og et mediastinalt kompartment
- UICC system med seks nivå på hver side og et mediastinalt nivå.
Lymfeknutedisseksjon er prinsipielt ikke indisert ved «lavrisiko-cancere».
Med hensyn til pre- og intraoperativ vurdering av lymfeknutene kan det skilles mellom profylaktisk og terapeutisk lymfeknutedisseksjon. Profylaktisk lymfeknutedisseksjon beskriver fjerning av lymfeknuter som verken klinisk eller bildemessig viser tegn til metastaser.
Ved terapeutisk lymfeknutedisseksjon er det påvist metastaser pre eller peroperativt.
Avhengig av tumortype og tumordiameter foreligger metastaser i inntil 30–50 % ved profylaktisk lymfeknutedisseksjon. På den andre siden er den prognostiske betydningen av små lymfeknutemetastaser, særlig ved PTC, usikker. Små metastaser kan dessuten behandles med radioaktiv jod. Sentral lymfeknutedisseksjon øker kirurgisk morbiditet særlig med tanke på hypoparathyroidisme, men også for forbigående og permanent recurrensskade. Profylaktisk lymfeknutedisseksjon er derfor noe kontroversiell. På den ene siden kan påvisning av mikroskopiske metastaser bidra til en upstaging av pasienter som medfører økt bruk av radiojod. På den andre siden kan noen grupper unngå radiojod dersom metastaser ikke påvises.
En profylaktisk lymfeknutedisseksjon i nivå VI bør også vurderes med tanke på redusert risiko for reoperasjon og komplikasjoner ved residiv i det sentrale kompartment. Sekundæroperasjoner har noe høyere risiko for skader av nervus recurrens og parathyroidea enn primæroperasjonen.
En mellomløsning kan være å gjøre ipsilateral profylaktisk lymfeknutedisseksjon.
Profylaktisk lateral eller mediastinal lymfeknutedisseksjon anbefales derimot ikke. Lymfeknutedisseksjon bør gjennomføres systematisk (fjerning av alle lymfeknutene og alt fettvev i et kompartment) og ikke som fjerning av bare enkelte knuter («berry picking»).
- Det anbefales å gjøre terapeutisk sentral (nivå VI) lymfeknutedisseksjon sammen med total thyreoidectomi for pasienter med kliniske metastaser i sentrale lymfeknuter, for å fjerne all sykdom i sentrale halsfelt.
- Profylaktisk sentral lymfeknutedisseksjon (ipsilateral eller bilateral) bør vurderes ved papillært tyreoideacarsinom som er T3 eller T4, klinisk involverte laterale lymfeknuter (cN1b), eller dersom informasjon om lymfeknutestatus brukes til å planlegge videre behandling.
- Thyreoidectomi uten profylaktisk sentral lymfeknutedisseksjon kan være tilstrekkelig for små (T1 eller T2), noninvasive, kliniske lymfeknutenegative PTC (cN0), og for de fleste follikulære cancere.
Terapeutisk lateral lymfeknutedisseksjon bør utføres hos pasienter med biopserte metastaser i laterale halslymfeknuter.
|
| Kompartmentsystem (Dralle) | UICC system (Robbins)1 |
|---|---|---|
| Cervicosentrale lymfeknuter | Kompartment 1 1a høyre side 1b venstre side | Nivå I (submentale og submandibulære lymfeknuter) Nivå VI sentrale lymfeknuter Nivå VII inferiore sentrale lymfeknuter2 |
| Cervicolaterale lymfeknuter | Kompartment 2 høyre side Kompartment 3 venstre side | Nivå IIA, IIB øvre jugulære lymfeknuter Nivå III midtre jugulære lymfeknuter Nivå IV nedre jugulære lymfeknuter Nivå VA, VB laterale jugulære lymfeknuter |
| Mediastinale lymfeknuter | Kompartment 4 (øvre infrabachiocephale lymfeknuter) 4a høyre side 4b venstre side | – |
1Nivå I (submentale og submandibulære lymfeknuter) er ikke del av det sentrale kompartmentet
2Nivå VII beregnes som inferior del av det sentrale kompartmentet, og som omfatter lymfeknutene som ligger superiort for vena brachiocephalica sinistra og som ofte ikke kan fjernes via cervical tilgang
Sentral lymfeknutedisseksjon (nivå VI)
Sentral lymfeglandeldisseksjon (nivå VI) omfatter de prelaryngeale, pretracheale og paratracheale/-øsofageale lymfeknutene. Ved kirurgi i denne regionen er både nervus recurrens, nervus laryngeus superior (ramus externus) og parathyroidekjertlene i fare for å bli skadet. Disseksjon må derfor utføres med spesiell forsiktighet.
Nervus laryngeus recurrens identifiseres alltid og følges visuelt. Bruk av intraoperativ nervemonitoring særlig ved bruk av permanent overvåkning av nervus vagus kan være en fordel og anbefales. Nervus laryngeus superior identifiseres, visuelt eller «negativt» ved at operatøren ser at nerven ikke inkluderes ved ligering av karene ved øvre pol.
Parathyroideakjertlene identifiseres og de to øvre kan ofte dissekeres fri med nativ karforsyning, mens de to nedre ofte må fjernes, findeles og implanteres i musculus sternocleidomastoideus (vevsdiagnosen parathyroidea kan ved behov kontrolleres med frysesnittundersøkelse). Implantasjonsstedet merkes med ikke-resorberbar tråd for å lette senere identifisering.
Lateral lymfeknutedisseksjon (nivå II, III, IV og V)
Dersom det er påvist metastaser til lymfeknuter i det laterale halsfelt preoperativt eller under operasjonen, skal det utføres lymfeknutedisseksjon på den affiserte siden, med bevaring av nervus accessorius, nervus vagus, nervus phrenicus, nervus hypoglossus, sympatiske grensestreng, plexusfasciklene, m. sternocleidomastoideus og v. jugularis interna.
Omfang av lateral lymfeknutedisseksjon ved DTC er ikke tilstrekkelig validert. Det er ikke klart om det ved lymfeknutemetastaser lokalisert til kun et nivå vil være tilstrekkelig å fjerne kun dette nivå, eller om det bør gjøres fullstendig kompartmentdisseksjon. Siden det ikke er mulig å utelukke flere metastaser ved påvist metastase i et nivå, bør fullstendig kompartmentdisseksjon utføres for å redusere residivrisiko.
Mediastinal lymfeknutedisseksjon
Etter Robbins klassifikasjonen omfatter nivå VII kun lymfeknutene som ligger superiort for vena brachiocephalica sinistra (anonyma). Det mediastinale kompartment etter Dralle inkluderer også de infrabrachiocephale lymfeknutene som kan bli involvert hos inntil 5–10 % av pasientene med store tumores. Mediastinal lymfeknutedisseksjon krever derfor vanligvis sternumsplitt, særlig hvis de retrocavale paratracheale lymfeknutene skal fjernes.
Ved mediastinal lymfeknutedisseksjon bør nervus vagus, nervus recurrens og nervus phrenicus identifiseres og bevares.
Det er ingen indikasjon for profylaktisk mediastinal lymfeknutedisseksjon. Ved påviste mediastinale lymfeknutemetastaser bør en mediastinal lymfeknutedisseksjon kun utføres hvis det ellers ikke er avansert generalisert eller raskt progredierende sykdom.
Kompletterende kirurgi
Ved postoperativ carcinomdiagnose etter utført ikke-total thyroidektomi må fullstendig fjerning av thyroidea og evt. lymfeknutedisseksjon vurderes.
Ved «lavrisiko carcinom» (solitær intrathyroidal nodal negativ PTC ≤10 mm, minimal-invasiv nodal negativ FTC ≤40 mm uten karinnvekst) og fullstendig fjernet tumor er ikke videre tiltak indisert.
Ved ikke-lavrisiko carcinom bør pasientene reopereres siden total thyroidektomi er forutsetning for radiojodbehandling. Kun ved veldig lite thyroidearestvev kan radiojodbehandling vurderes uten kompletterende kirurgi.
I forhold til lymfeknutedisseksjon gjelder prinsipielt anbefalingene som er gitt for primærsituasjonen. Likevel bør indikasjon for profylaktisk lymfeknutedisseksjon grundig vurderes siden risiko for kirurgi-assosierte komplikasjoner er økt ved reoperasjon. Profylaktisk sentral lymfeknutedisseksjon bør imidlertid alltid utføres ved pT3 eller pT4 PTC.
Hvis det er indikasjon for kompletterende kirurgi, bør operasjonen utføres enten i løpet av 4 dager eller 3 måneder etter første operasjon.
Kirurgi ved lokoregionalt residiv
Ved lokalt residiv er det vanligvis indikasjon for ny operasjon.
Omfang og tidspunkt for operasjonen bør bestemmes individuelt i forhold til estimert prognose, pasientens situasjon og operasjonsrisiko.
Det bør skilles mellom lokalt residiv som oftest er lokalisert paratrachealt eller paraøsofagalt, med økt risiko for infiltrasjon av vitale organer, og lymfeknutemetastaser som kan sitte i en viss avstand fra de vitale strukturene. Det kan også forekomme bløtvevsmetastaser i for eksempel muskulaturen.
Noen residiv vokser veldig langsomt og kan til og med i noen tilfeller observeres, mens andre residiv viser rask progresjon som krever hurtig operasjon. Vurderingen krever god kunnskap og betydelig erfaring med slike pasienter.
Som ved primærkirurgi bør kirurgi ved residiv utføres som systematisk og kompartment-orientert kirurgi. Ved residiv i et tidligere omfattende operert kompartment kan en selektiv lymfeknutefjerning være tilstrekkelig.
Hos pasienter som ikke er operable, og ved nye lymfeknutemetastaser i allerede opererte områder, har ultralydveiledet etanolinjeksjon vist seg som et meget godt alternativ til kirurgi.
Lokalavansert differensiert thyroideacarcinom
Dette er en undergruppe der utredning og behandling skiller seg fra anbefalte retningslinjer for behandling av thyroideacarcinom uten lokal invasivitet, og utredning og behandling må tilpasses dette. Lokalt invasiv thyroideacarcinom representerer en alvorlig prognostisk gruppe i en ellers relativt indolent pasientpopulasjon. Kirurgien må ivaretas og utføres i sentra med tilstrekkelig spesifikk ekspertise og i samarbeid med tverrfaglig team som dekker alle behandlingsopsjoner. Differensieringsgrad og invasjonsmønster er av stor betydning for behandlingsstrategi. Forekomsten er ca 15 % (3–16 %) av nydiagnostiserte pasienter med thyroideacarcinom.
Lokalavansert thyroideacarcinom defineres som T4 stadium med ekstrakapsulær ekstensjon. Ved lokalavansert carcinom finnes det innvekst i muskulatur (55 %), nervus recurrens (ca. 45 %), trachea (ca. 35 %), øsofagus (ca. 20 %), vena jugularis interna og (veldig sjelden) arteria carotis communis. Innvekst i larynx er sjeldnere. Vanligvis er det direkte ekstensjon fra tumor i thyroidea, men også lokal innvekst fra metastaser kan gi tilsvarende problemer.
Lokal invasivitet er en prognostisk negativ faktor og indikerer en redusert langtidsprognose. Sammenlignet med andre prognostiske faktorer som alder, kjønn, histologi, tumorstørrelse og fjernmetastaser, er ekstrathyroidal invasjon den faktor som har størst negativ betydning for pasienter med høy-differensiert thyroideacarcinom med reduksjon fra 91 % til 45 % ti-års overlevelse. Hos ca. 50 % av de som dør av DTC skyldes det lokal tumorinvasjon, hovedsakelig på grunn av kvelning og blødning ved lokoregionale residiv.
Reseksjoner av nervus recurrens, trachea, øsofagus og larynx medfører signifikant postoperativ morbiditet. Behovet for radikalitet må veies opp mot morbiditet som følge av kirurgi og ekstensive reseksjoner. Ved høyt differensierte cancere er lokal mikroskopisk radikalitet sannsynligvis ikke så avgjørende for langtidsprognosen som ved lavt differensierte varianter der særlig effekt av radiojod ikke kan påregnes.
Kirurgisk reseksjon er av avgjørende betydning i behandling av lokalavansert DTC, med komplett reseksjon med frie marginer som hovedmål. Denne gruppen skal ha også ha ablasjon med radioaktivt jod og livslang suppresjonsbehandling. Hos enkelte bør ekstern strålebehandling vurderes særlig ved ikke mikro- eller makroskopisk frie reseksjonsrender.
Strategi for kirurgisk reseksjon
1. Rette muskulatur
Ved mistanke om invasjon bør musculus sternothyroideus resesseres, evt. også musculus sternohyoideus. Enkelte anbefaler regelmessig reseksjon av musculus sternothyroideus ved anteriort beliggende tumor. Dette har lite eller ingen funksjonell følge, med mulig unntak for sangere, og ingen stor konsekvens.
2. Nervus recurrens
En preoperativt fungerende nerve som er adherent til et carcinom eller lymfeknutemetastase, kan ofte dissekeres fri fra tumor og bevares uten reseksjon så lenge det ikke etterlates noen makroskopisk tumor. Studier har vist at det ikke er forskjell i overlevelse ved reseksjon kontra preservasjon, så fremt det gis radioaktiv jod. Jod-aviditet er imidlertid vanligvis ikke kjent preoperativt, men histologisk aggressiv eller lavt differensiert tumor er mulig indikasjon for mer aggressiv kirurgi. Når nerven er infiltrert og har nedsatt funksjon bør den komplett resesseres en bloc med tumor. Kompensatorisk korrigerende kirurgi i form av thyroplastikk (dersom symptomatisk) kan vurderes senere. Nervesutur eller interposisjon av nerver (for eksempel ansa cervicalis) kan vurderes. Veldig sjelden kan lokal kompresjon av nerven medføre nedsatt funksjon. Nerven bør om mulig bevares siden funksjonen kan komme tilbake etter dekompresjon.
Bilateral recurrensparese er en alvorlig komplikasjon som vanligvis fordrer trakeotomi for å holde fri luftvei. Preoperativ stemmebåndsundersøkelse er avgjørende for å unngå reseksjon av eneste fungerende nervus recurrens, og det anbefales intraoperativ nervemonitorering særlig dersom det foreligger en preoperativ ensidig recurrensparese.
3. Trachea
Invasjonsmønsteret og dybdeinfiltrasjon er av avgjørende betydning ved valg av kirurgisk strategi.
Høyt differensiert tumor uten invasjon i perikondriet eller gjennomvekst av veggen (stadium I) kan ofte fjernes ved hjelp av tangential veggreseksjon (shaving).
Ved gjennomvekst av veggen (stadium II-IV) eller lavt differensiert tumor bør en tracheal reseksjon utføres enten i form av et vindu med rekonstruksjon, eller circumferensiell med ende til ende anastomose. Frysesnitt for vurdering av marginer anbefales. Vanligvis kan 5–6 cm av trachea resesseres. Dette er prosedyrer som kun bør utføres ved sentra med betydelig spesifikk kirurgisk kompetanse og intensivmedisinsk ekspertise (OUS-RH/Haukeland).
4. Larynx
Invasjon i larynx er indikasjon for individuell tilrettelagt kirurgisk strategi og vanligvis partiell laryngeal reseksjon.
5. Øsofagus
På grunn av anatomiske forhold involveres øsofagus vanligvis sent, og oftest kun muskularis-laget, sjeldnere mucosa. Plassering av en stor sonde i øsofagus er til hjelp i vurderingen av om det er mulig å spare mucosa. Dersom gjennomgående reseksjon er nødvendig, må denne lukkes vanntett uten tensjon, eventuelt med vaskularisert lapp, og må utføres av kirurg med spesifikk rekonstruktiv erfaring. Autolog tynntarmtransplantasjon kan være nødvendig.
6. Karinvasjon
Det foreligger relativt sjelden innvekst i vena jugularis eller arteria carotis. Vena jugularis kan ukomplisert fjernes på en side. Dersom indisert, krever reseksjon av arteria carotis communis vanligvis interponat med vene eller protese.
Profylaktisk kirurgi
Ved familiær DTC er det vanligvis ikke indikasjon for profylaktisk kirurgi (thyroidektomi).
Medullært thyroideacarcinom
MTC regnes som en mer avansert og alvorlig sykdom enn differensiert thyroideacarcinom. På grunn av dette, og fordi forekomsten er lavere, bør pasienter med MTC kun behandles i sentere med bred erfaring (fortrinnsvis universitetssykehus).
MTC har gjerne tidlig i sykdomsforløpet lymfeknute- og fjernmetastaser (skjelett, lunge, lever). Ca. 25 % av pasientene med MTC har en arvelig bakgrunn ved aktiverende kimbanemutasjoner i RET proto-onkogenet (MEN 2, multippel endokrin neoplasi) med mutasjons-avhengig risiko for feokromocytom og primær hyperparathyroidisme (genotype-fenotype-korrelasjon).
Familiær MTC deles inn i FMTC (kun MTC), MEN 2A (MTC, primær hyperparathyroidisme (PHPT), feokromocytom) og MEN 2B (MTC, feokromocytom, karakteristisk fenotype med oro-gastro-intestinal ganglioneuromatosis, øyeforandringer og abnormal utvikling av det muskuloskjelettale systemet, ikke PHPT).
Som sensitive tumormarkører brukes basal og stimulert s-calcitonin og CEA. S-calcitonin har vist seg å være et sensitivt verktøy med hensyn til (a) sannsynligheten av lymfeknutemetastaser og (b) prognosen. Ved MEN 2 utvikles MTC via neoplastisk c-celle-hyperplasi (hyperplasi-carcinom-sekvens). Det er en kontroversiell diskusjon om sporadiske MTC også utvikler seg via c-celle-hyperplasi eller de-novo. Omvendt er det ukjent om pasienter med sporadisk c-celle-hyperplasi har en risiko for å utvikle MTC.
Pasienter med påvist eller suspekt MTC bør i tillegg til ultralyd hals undersøkes med måling av s-calcitonin og CEA. Kontrast-CT eller MR av hals, thorax og abdomen bør vurderes ved høye s-calcitonin verdier for å utelukke mediastinale lymfeknutemetastaser og fjernmetastaser. I tillegg kan en skjelettscintigrafi være indisert ved tydelig forhøyet s-calcitonin.
Dersom RET proto-onkogenet ikke har blitt analysert før operasjonen bør s-calcium, PTH, p-metanefrin og p-normetanefrin måles for å utelukke feokromocytom og primær hyperparathyroidisme. Prinsipielt sett er det imidlertid obligat å analysere RET proto-onkogenet hos alle pasienter med MTC.
Pasienter med MEN 2A har mutasjons- og aldersavhengig risiko for PHPT og feokromocytom. Begge tilstander må utredes i forkant av operasjon for MTC. Ved PHPT må operasjonsstrategien i halsen tilpasses, ved feokromocytom må binyreoperasjonen utføres før halsoperasjonen. Dette bør også vurderes hos pasienter med FMTC (selv om forekomst av PHPT eller feokromocytom er svært sjelden) og MEN 2B (PHPT er ikke del av syndromet).
Operasjonsomfang ved primæroperasjon
Standardomfang er vanligvis total thyroidektomi og sentral lymfeknutedisseksjon både ved sporadisk og familiær MTC.
Lymfeknutedisseksjon bør utføres som systematisk og kompartment-orientert fjerning av alt bløtvev (lymfeknuter og fettvev) i mikrodisseksjonsteknikk.
Profylaktisk lateral lymfeknutedisseksjon bør vurderes ved høy s-calcitonin. Det er kontroversielt om det i så fall bør utføres kun ipsilateral lateral lymfeknutedisseksjon, eller bilateral lateral lymfeknutedisseksjon. Omfanget bør bestemmes avhengig av s-calcitonin, diameter av primærtumor og pasienten. Det anmerkes at det ikke foreligger entydige «cut-off» verdier.
Profylaktisk mediastinal lymfeknutedisseksjon er ikke indisert.
Terapeutisk cervical lymfeknutedisseksjon er vanligvis indisert hos alle pasienter med påvist lymfeknutemetastaser. Terapeutisk mediastinal lymfeknutedisseksjon bør vurderes ved mediastinale lymfeknutemetastaser. Mediastinale lymfeknutemetastaser bør fjernes hvis disse truer å infiltrere viktige organer, og pasientene befinner seg i en stabil sykdomssituasjon.
Kompletterende kirurgi
Hos pasienter med insidentelt funnet MTC etter kirurgi må en genetisk bakgrunn utelukkes (fullstendig RET proto-okongen analyse er obligatorisk).
Etter utført total thyroidektomi er det verken ved sporadisk eller familiær MTC indikasjon for ytterligere operasjon dersom s-calcitonin ligger både basalt og stimulert under deteksjonsgrensen.
Pasienter med sporadisk MTC som ble operert med mindre enn total thyroidektomi bør kompletteres med total thyroidektomi hvis tumordiameter er >20 mm eller ved patologisk stimulasjonstest. Pasienter med unifokal MTC ≤20 mm og ikke stimulerbar s-calcitonin kan oppfølges uten kompletterende kirurgi dersom pasienten er informert og har gitt samtykke.
Omfanget av lymfeknutedisseksjon bør bestemmes avhengig av s-calcitonin.
Kirurgi ved residiv
Ved cervicalt residiv er det stort sett alltid indikasjon for ny kirurgi siden infiltrasjon av nerver, kar, trachea eller øsofagus kan bli livstruende («The neck is the pacemaker of the disease»). Hittil ikke opererte kompartmenter bør fjernes fullstendig i ovennevnte teknikk. Ved residiv i primæropererte kompartmenter kan en selektiv tumorreseksjon vurderes. Etanolinjeksjon i lymfeknutemetastaser kan hos enkelte være et alternativ til kirurgi i tidligere opererte områder.
Lokalavansert medullært thyroideacarcinom
Ved MTC med invasjon i nerver, kar, trachea eller øsofagus, bør en utvidet reseksjon vurderes hos pasienter som er i god allmentilstand uten påvisbare fjernmetastaser, eller i utvalgte tilfeller ved isolerte metastaser til lever eller lunge men med stabile s-calcitonin verdier. Vurderingen vil være avhengig av infiltrasjonsgrad.
Profylaktisk kirurgi
Hos personer med kjente sykdomsrelevante RET kimbanemutasjoner er det indikasjon for kirurgi før MTC oppstår (profylaktisk fjerning av thyroidea, evt. med sentralt lymfeknutetoalett).
I følge ATA retningslinjer deles det inn i fire risikogrupper med hensyn til aldersavhengig risiko for å utvikle MTC (se ovenfor: genotype-fenotype-korrelasjon): gruppe A omfatter de minst aggressive RET-mutasjoner, mens gruppe D omfatter MEN 2B pasienter. Sistnevnte pasienter må opereres så fort som mulig og muligens i løpet av det første leveåret. Hos alle andre (gruppe A-C) er det anbefalt å fjerne thyroidea før skolealderen. Tidspunktet bør bestemmes etter måling av basal og evt. stimulert s-calcitonin. Hos pasienter i gruppe A (og evt. gruppe B) kan det være forsvarlig å utsette operasjonen til >10 (-20) års alder hvis s-calcitonin er normal (årlig undersøkelse).
For utfyllende informasjon vises det til ATA retningslinjer for pediatrisk thyroideacancer.
Vedrørende stimulasjonstest se kliniske symptomer, avsnitt om "symptomer som krever rask utredning (alarmsymptomer)".
Anaplastisk thyroideacarcinom
ATC er den mest aggressive og hurtigvoksende solide tumor i thyroidea. Den vokser raskt lokalt på halsen, gir hyppig recurrensparese og pustebesvær. Alle ATC klassifiseres som T4 (se kapittel 5). Fjernmetastaser opptrer gjerne initialt eller innen få måneder. De fleste ATC er lokalavanserte (T4b) ved diagnose, og nesten ingen helbredes uansett terapeutisk tilnærming. Median levetid er under ett år. Hos de få som helbredes foreligger det gjerne et lite, intrathyroidalt fokus av ATC i et struma eller et DTC (T4a).
ATC behandles kun ved universitetssykehus.
Lokal kontroll er viktig på grunn av symptomer og livskvalitet. Preoperativ hyperfraksjonert strålebehandling kan gi bedre lokal kontroll enn kirurgi alene. Tumorcellene har en rask celledeling, og derfor en høy veksthastighet. Der er betydelig gjenvekst mellom strålefraksjonene dersom disse bare gis en gang daglig.
Dersom det foreligger resektabel tumor er total thyroidektomi med profylaktisk eller terapeutisk sentral lymfeknutedisseksjon standardoperasjon. Ved lymfeknutemetastaser i de laterale kompartment kan en lateral lymfeknutedisseksjon vurderes, men ofte reflekterer denne situasjonen inkurabilitet. Hos risikopasienter kan det være en fordel å redusere operasjonens omfang til reseksjon av den tumorbærende thyroidealappen. Tumorvolum-reduserende kirurgi har ingen effekt på prognosen.
Svært ofte er tumor imidlertid verken primært eller sekundært operabel, da gis definitiv strålebehandling til høyere doser, se 6.4.2.
Krav til operasjonsbeskrivelse
Operasjonsbeskrivelsen må inneholde en kort beskrivelse av indikasjonen og at pasienten er informert om dette, og om risiko både for eventuell stemmebåndskade og nedsatt parathyroideafunksjon og andre komplikasjoner.
Diagnosen og prosedyren bør eksakt angis sammen med riktig koding.
Bruk av spesielt utstyr (for eksempel ultralydsaks, andre spesielle disseksjonshjelpemidler, nervemonitorering) bør nevnes.
Operasjonsbeskrivelsen skal inneholde en kort beskrivelse av den anatomiske situasjonen og tumor (lokalisasjon, størrelse, infiltrasjon av andre organer, suspekte lymfeknuter, anatomiske varianter). Hele operasjonen bør beskrives i alle relevante aspekter. Ved vanskelig eller tidkrevende disseksjon bør dette anføres. Særlig håndteringen av nervene (minst nervus recurrens, nervus vagus og nervus laryngeus superior) og parathyroideakjertlene må beskrives. Når det gjelder parathyroidea bør det gis informasjon om hvor mange som ble funnet/bevart/ autotransplantert/merket/biopsert. Med hensyn til nervene skal det beskrives på hvilken måte nervene ble identifisert og hvor. Ved bruk av nervemonitoring bør resultatene og teknikk angis.
Operasjonsomfang må beskrives. Ved lymfeknutedisseksjon skal operasjonsbeskrivelsen gi nøyaktig informasjon om omfanget og intraoperative funn.
Operasjonsresultatet må angis (for eksempel makroskopisk radikal/ikke radikal operasjon).
Intraoperative komplikasjoner må nevnes.
Det bør angis på hvilken måte hemostase ble utført (for eksempel bruk av hjelpemidler), og på hvilken måte halsen ble lukket.
Operasjonsbeskrivelsen bør også inneholde postoperative beskjeder i tilfellet slike gis.
Håndtering av operasjonsmaterialet
Remissen må inneholde kliniske opplysninger og evt. spesielle problemstillinger. Kirurgen må merke preparatene for eksempel med sutur i øvre thyroideapol. Operasjonspreparatet bør i minst mulig grad være skåret i. Spesielle lesjoner bør merkes med sutur og beskrives i remissen. Lymfeknuter kan med fordel monteres på isoporplate, og ulike grupper og lymfeknutestasjoner markeres.
Profylakse og håndtering av komplikasjoner
Nerveskader
- Nervus recurrens (nervus laryngeus inferior)
- Nervus laryngeus superior (ramus externus)
- Nervus accessorius
- Nervus hypoglossus
- Nervus phrenicus
- Sympatikusskade
Prinsipielt gjelder at nervene bør fremstilles og identifiseres hvis det dissekeres i nærheten av dem.
Dette gjelder særlig nervus recurrens både ved thyroidektomi og sentral lymfeknutedisseksjon. Under operasjonen skal nervus recurrens aktivt identifiseres visuelt ved forsiktig disseksjon. Identifikasjon inferiort for thyroidea kan være sikrest fordi nerven kan dele seg i flere grener. Også kapselnær disseksjon uten visuell identifikasjon kan medføre nerveskade, spesielt ved cancer. Samtidig må man ikke strekke eller manipulere for mye med nerven eller diatermere blodkar på eller like ved nerven. Ved differensiert thyroideacarcinom er det sjeldent indikasjon for å ofre nerven. Selv ved adherent tumor har radikal reseksjon med nerven ikke gitt bedre prognose enn nervebevarende kirurgi.
Alle pasienter skal undersøkes pre- og postoperativt med laryngoskopi for å dokumentere stemmebåndsfunksjonen samt endotracheale forhold. Nedsatt stemmebåndsfunksjon preoperativt kan gi mistanke om invasivt voksende tumor. Profesjonelle stemmebrukere (spesielt sangere) bør undersøkes med stroboskopisk laryngoskopi.
Intraoperativ nervemonitorering kan være til hjelp for å identifisere nerven. Selv om det ikke er vist at rutinemessig nervemonitorering bedrer resultatene ved primæroperasjon, gjør det at man kan verifisere den visuelle identifikasjonen av nerven, og gjør disseksjonen lettere om det er vanskelig anatomi pga primærtumor eller sentrale lymfeknutemetastaser. Det kan være særlig nyttig ved total thyoidektomi og ved kompletterende eller residivkirurgi. Signaltap kan påvirke operasjonsstrategien i tilfellet det påvises nerveskade etter utført første side (for eksempel utsette side nr. 2 til nerven har fått normal funksjon tilbake). For sikkert å kunne tolke og stole på nervemonitorering, anbefales det brukt regelmessig.
Kontinuerlig nervemonitorering av nervus vagus er under utprøving, særlig med hensyn på om truende nerveskader kan oppdages så lenge de er reversible. Konklusive data foreligger hittil ikke. Nervemonitorering tillater vurdering av stemmbåndsfunksjon etter utført kirurgi uten at laryngoskopi er umiddelbart nødvendig.
Nervus laryngeus superior (ramus externus) har variabelt forløp i forhold til øvre thyroideapol. Det er usikkert om generell identifisering av denne nerven vil ha fordeler. Ved ligatur av arteria thyroidea superior og mobilisering av øvre thyroideapol, bør man imidlertid forsikre seg om at nerven ikke blir skadet.
Ved lateral lymfeknutedisseksjon bør nervus accessorius, nervus hypoglossus, nervus phrenicus og truncus sympathicus bevares. Dette forutsetter vanligvis at disse nervene identifiseres.
1. Ensidig rekurrensskade
Rekurrensskade defineres som nedsatt ab- og adduksjon av ipsilaterale stemmebånd. Stemmebåndet inntar vanligvis en paramedian eller intermediær stilling. Dette gir ufullstendig lukking av stemmespalten og dysfoni, dårlig motstand ved hosting, aspirasjonstendens og tale- og anstrengelsesdyspnoe. Stemmen blir klangfattig med luftlekkasje og redusert toneregister. Stemmen kan postoperativt være relativt normal, men ved tiltagende atrofi av denervert muskulatur blir problemene mer fremtredende. Sjeldnere er stemmebåndet i median stilling hvilket gir dyspnoe, men mindre stemmepåvirkning.
Reanastomosering av nervus recurrens ved reseksjon for tumorinvasjon gir ikke funksjon (autoparalyse) og men kan gi tonus og redusert atrofi av stemmebåndet.
Ved verifisert skade bør pasienten oppmuntres til å bruke stemmen. Stemmehvile er uhensiktsmessig. Samtidig skal pasienten henvises til logoped for å forebygge feil bruk av ekstern larynxmuskulatur (kompensatorisk). Mindre enn halvparten av pasientene får spontan bedring av stemmebåndsfunksjonen. Tidlig injeksjonbehandling kan vurderes.
Er det fortsatt paralyse med nedsatt stemmekvalitet etter et år, bør pasienten vurderes med tanke på kompensatorisk kirurgi. Økt støtte og fylde i stemmebåndet kan oppnås ved /implantasjon av fettvev, injeksjon (hydroxylapatite eller hyaluronsyre) eller protese (thyroplastikk). Medialisering av stemmebåndet kan gi bedre lukning av stemmespalten.
2. Bilateral rekurrensskade
Ved bilateral rekurrensskade er symptomene avhengig av stemmebåndenes stilling. Stemmen er desto bedre jo nærmere stemmebåndene står midtlinjen, men samtidig blir stridor og dyspnoe mere uttalt. Ved postoperativ stridor må reintubasjon eller trakeotomi vurderes. Ved vedvarende bilateral paralyse kan bakre kordektomi (ekstirpasjon av bakre del av stemmebåndet) redusere stridor og dyspnoe, men vil samtidig gi dårligere stemmefunksjon. For disse pasientene er stemmetrening hos logoped indisert.
3. Skade av nervus laryngeus superior
Skade på nervus laryngeus superior (som innerverer musculus cricothyroideus (hjelper med å addusere og stramme stemmebåndet)) kan gi lavere toneleie og reduserer øvre del av toneregisteret. Sensoriske fibre er viktige for beskyttende reflekser, og skade kan gi aspirasjonstendens.
Anamnese og stroboskopisk laryngoskopi med påvisning av økt glottisbølgeamplitude gir gode holdepunkt for diagnosen.
4. Skade av nervus accessorius
Skade av nervus accessorius gir hengende skulder og problemer med å løfte armen over horisontalplanet i rett lateral eller bakre stilling på grunn av parese av musculus trapezius. Ved lateralt lymfeknutetoalett skal nerven aktivt identifiseres. Differensiert thyroideacarcinom gir sjelden grunn for å ofre nerven. Nedsatt funksjon kan allikevel forekomme og er lett å identifisere umiddelbart postoperativt. Ved omfattende arrdannelse kan gradvis redusert funksjon inntre. Skulderøvelser er viktige for å opprettholde mest mulig av skulderfunksjonen og pasienten bør henvises til fysioterapeut.
5. Skade av truncus sympathicus
Skade av sympatiske grensestreng kan gi Horners syndrom. Ved uttalte symptomer kan pasientene henvises til øyelege til vurdering av øyelokk-kirurgi.
6. Skade av nervus hypoglossus
Skade av nervus hypoglossus kan opptre etter submandibulær disseksjon, og er oftest forbigående. Ved permanent skade bør pasientene vurderes av ØNH lege.
Hypocalcemi
Hypocalcemi postoperativt kan være forbigående eller permanent. Årsakene kan være operasjonstraumet i seg selv med ødem i området den første tiden etter operasjonen, skadet eller midlertidig nedsatt karforsyning til parathyroidea, eller at parathyroideakjertlene har blitt med i resektatet. Operasjonspreparatet undersøkes med hensyn på om parathyroideakjertler har blitt aksidentelt fjernet. Om parathyroideakjertler identifiseres, bør disse reimplanteres.
Etter total thyroidektomi er det ikke uvanlig med lette hypocalcemi-symptomer en kort periode. Insidensen av permanent postoperativ hypocalcemi ligger på ca 2 % avhengig av kirurgens erfaring og tumorens utbredelse.
Ved reoperasjon er risikoen for postoperativ hypocalcemi betydelig økt, og det er også av den grunn viktig at det første inngrepet er så radikalt som nødvendig.
Dersom kirurgen ser at en parathyroideakjertel blir devaskularisert eller har blitt med thyroidearesektatet ut, skal/bør parathyroideakjertelen autotransplanteres. En slik finsnittet, transplantert kjertel vil vanligvis gjenoppta sin funksjon i løpet av få uker til 2–3 måneder. Vanligvis implanteres vevet i en lomme i musculus sternocleidomastoideus. Lommen bør merkes med ikke resorberbar tråd. Ved MEN 1 og 2 med risiko for HPT bør transplantasjonen foretas i underarmen.
Disseksjonen i det sentrale kompartment bør gjøres forsiktig med hensyn til parathyroideakjertlene og deres blodforsyning. Det er kontroversielt om kjertlene bør aktivt identifiseres. Om man ikke finner kjertlene på vanlig sted og man er sikker på at kjertlene ikke er med i reseksjonspreparatet, er det er ikke anbefalt å lete etter eventuelt ektopisk lokaliserte kjertler.
Akutt hypocalcemi
Symptomer oppstår ofte de første postoperative døgnene, gjerne allerede få dager etter utført kirurgi, og kan omfatte stikninger og nummenhet i ekstremitetene og ansiktet, og kramper særlig i de små musklene (tetani). Akutt postoperativ hypocalcemi er ofte en skremmende og traumatisk opplevelse for pasienten. Det er imidlertid ikke streng korrelasjon mellom s-calcium og symptombilde, og mange pasienter med lav s-calcium er klinisk asymptomatiske. Profylaktisk substitusjon av både calcium og vitamin D bør vurderes i forhold til den intraoperative situasjon.
Pasienten må derfor informeres om risikoen for å kunne få hypocalcemi etter operasjonen, og kunnskap om symptomene på lav s-calcium, klinisk observasjon og daglig måling av s-calcium er nødvendig. Måling av PTH intra- eller postoperativt kan være nyttig for å kunne vurdere videre forløp.
Det er ikke konsensus med hensyn til når substitusjonsbehandling bør startes ved asymptomatiske pasienter. Indikasjonen er klar ved symptomer. Oral calciumsubstitusjon bør foretrekkes. Ved lav s-calcium kan det være en fordel å gi calcium regelmessig, og om nødvendig i tillegg ved behov. Calciumtabletter (eller brusetabletter) á 500 mg kan gis flere ganger per døgn. Det er liten risiko for overdosering med calciumtabletter, da pasienten vanligvis blir oppmerksom på symptomene på lav calcium og kan dosere seg selv for å holde symptomene borte. Det kan være en fordel å gi en fast dose med for eksempel 2 g per døgn og substituere videre etter behov.
Ved kraftige symptomer eller uttalt hypocalcemi (< 1,8 mmol/L albuminkorrigert) som er refraktære på oral substitusjon, bør calcium gis langsomt intravenøst (for eksempel 20 mmol calciumklorid i 500 ml NaCl over 12 timer). Initialt kan en ved kramper gi calcium 5 mmol i 50 ml NaCl over 10 minutter. Noen behøver calciuminfusjon gjentatt over flere døgn. Når tilstanden tillater det, bør man gå over til oral calciumtilførsel
Dersom vitamin D-status ikke er sjekket eller korrigert før operasjonen, kan det ved uttalte symptomer gis engangstilskudd kolekalsiferol 100.000 IU (Detremin 5 ml i løpet av 1 dag, eventuelt fordelt på to doser). Ellers bør indikasjon for vitamin D-substitusjon vurderes individuelt. Det anbefales enten calcitriol (0,5–1 μg per døgn) eller alfacalcidiol (0,5–1 μg per døgn) med tillegg av calcium 500 mg daglig, evt mer ved behov. Høye calciumdoser over uker og måneder bør unngås for å unngå utfellinger av kalk i urinveier og i verste fall nefrocalcinose. Det er da bedre å starte med vitamin D tidlig, slik at calciumtilførselen kan reduseres.
Ved lav s-magnesium bør magnesium substitueres. Hvis det er lette symptomer anbefales magnesium 120 mg x 3 daglig peroralt. Dersom s-magnesium er <0,7 mmol/L og pasientene har kraftige symptomer, bør man vurdere å gi magnesium intravenøst, forslagsvis 10–30 mmol MgSO4 eller MgCl, i 1000 ml NaCl over 6 timer, forutsatt normal nyrefunksjon
Calcium og vitamin D bør trappes ned gradvis. Det er viktig å ikke overbehandle. S-calcium bør ligge ved nedre normalgrense.
Kontroll med albuminkorrigert s-calcium bør gjennomføres med 2 ukers mellomrom inntil stabilt nivå. PTH bør måles hver 2. måned for å vurdere parathyroideafunksjonen. Er PTH målbar eller til og med i normalområdet og alle symptomer på hypocalcemi opphører, bør behandlingen forsøksvis stoppes, da parathyreoidea-kjertlene kan være restituert.
Permanent hypocalcemi
Dersom hypocalcemiproblemet fortsetter mer enn 1 år, har pasienten fått permanent postoperativ hypocalcemi. Da behøves livsvarig behandling med høy dose av vitamin D eller aktivert vitamin D (vitamin D-analog ), og et kontrollopplegg som innebærer regelmessig oppfølgning av calciumstatus.
Basisbehandling er tilskudd med calcium 500–1000 mg daglig samt 800 IU vitamin D3 pr dag.
I tillegg behøver pasienten ofte behandling med vitamin aktivert vitamin D som har relativt kort halveringstid og rask effekt, for eksempel calcitriol 0,5–3 μg daglig eller alfacalcidiol 0,5–3 μg daglig. Oppstart av potent aktivert vitamin D bør foregå med langsom doseøkning fra laveste anbefalte dose, hvis man ikke har tidligere doser å støtte seg til.
Dersom en velger å bruke aktivert vitamin D, bør pasienten også ha tilskudd med vanlig vitamin D-preparat (800 IU per dag), dersom 25(OH)D < 60 nmol/L.
Ved innstilling av behandling med vitamin D og calcium bør s-calcium ligge omkring eller like under nedre normalgrense (2,15–2,20 mmol/l). Calcium (ionisert eller albuminkorrigert) bør, når alt har stabilisert seg, kontrolleres hver 3.–6. måned hos pasient som bruker permanent vitamin-D-analog. Calcium- og fosfatutskillelse i urinen bør følges. D-vitaminbehandling medfører fare for høy calciumutskillelse i nyrene og dermed risiko for utvikling av nyresykdom, særlig hvis s-calciumnivået ikke ligger lavt og hvis s-fosfatverdiene blir høye. Man bør prøve å holde D-vitamindoseringen lav, unngå høye fosfatverdier, og redusere renal utskillelse ved å gi magnesiumtilskudd, thiazid eller fosfatbinder.
Dersom det foreligger magnesiummangel (< 0.70 mmol/L) gis peroralt tilskudd med 120 mg x 1–3 per dag.
Pasienter med permanent hypocalcemi har alltid PTH-mangel. Vedlikeholdsbehandling med PTH som daglig subkutan injeksjon eller kontinuerlig infusjon(1–2 µg), er foreløpig på utprøvningsstadiet.
Blødning
Blødninger etter thyroideakirurgi kan bli livstruende og må behandles umiddelbart med reoperasjon. Sykehus som driver thyroideakirurgi må ha en faglig tilfredstillende beredskap til å håndtere dette, både mhp kirurg og anestesi. Sykehuset har ansvar for at det er vakthavende personell tilstede som har kompetanse til å håndtere problemet. Blødning gjør operasjonsfeltet uoversiktlig og medfører risiko for skade på recurrensnerve og biskjoldbruskkjertler.
Infeksjon
Dyp infeksjon kan være en farlig komplikasjon med risiko for mediastinitt og erosjonsblødning. Antibiotika gis og operativ drenasje bør vurderes.
Chyluslekkasje
Særlig ved lateral lymfeknutedisseksjon inferiort på venstre side (nivå IV) kan det komme lekkasje fra ductus thoracicus der den munner inn i venevinkelen mellom vena jugularis interna og vena subclavia. Erkjennes dette intraoperativt kan man lukke den med clips eller forsiktig suturering, gjerne med dekning av muskulatur eller injeksjon av fibrinlim i ductus.
Ved postoperativ lekkasje kan det forsøkes behandlet med lokal kompresjon og passivt dren. Effekt av diett er usikker. Octreotid kan prøves, men det foreligger ikke evidens. Ved vedvarende fistel med volum >500 ml bør reoperasjon vurderes.