Utredningen skal sannsynliggjøre diagnosen og avklare lokalisasjon, størrelse og utbredelse av primærtumor og om det foreligger metastaser. Bildediagnostikken danner grunnlaget for å vurdere om kirurgisk behandling med kurativ intensjon er mulig, men framskaffer også viktig informasjon i forhold til andre behandlingsvalg.
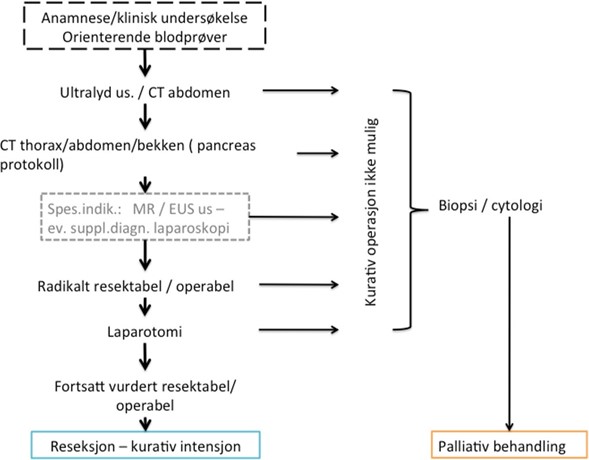
Ved sterk klinisk mistanke om pancreaskreft skal det utføres dedikert CT pancreas, og samtidig CT thorax og bekken for kartlegging av eventuelle fjernmetastaser (Al-Hawary et al., 2014). I mange tilfeller kan pasienten ha presentert seg med uspesifikke symptomer i øvre abdomen, og det kan primært være utført andre typer undersøkelser, som CT abdomen i én fase (portovenøs fase), ultralyd eller MRCP. Ved funn av tumor eller tumorsuspekte funn på CT abdomen, ultralyd eller MRCP skal det gjøres supplerende diagnostikk og preoperativ kartlegging med dedikert CT pancreas, med mindre pasienten av ulike årsaker ikke er aktuell for operativt inngrep med kurativ intensjon (Al-Hawary et al., 2014).
Både CT og MR har stor treffsikkerhet for diagnostikk og lokoregional stadieinndeling ved pancreaskreft. CT pancreas er referansemodalitet fordi den gir best kartlegging av relevante blodkar (Al-Hawary et al., 2014). MR pancreas kan benyttes ved kontraindikasjoner mot CT med kontrast (kontrastallergi). MR er et viktig supplement til CT når mistenkt tumor ikke er synlig på CT, ved uavklarte leverlesjoner og når CT-funnene ikke entydig kan skille pancreaskreft fra andre differensialdiagnoser (Toft et al., 2017). MR brukes også ved utredning av cystiske pancreaslesjoner (Norsk Gastrointestinal Cancer Gruppe - HPB, 2024).
For diagnostikk og stadieinndeling utføres «CT Pancreas protokoll» som inkluderer CT Pancreas (2 fase) + resten av abdomen/bekken og CT thorax (Al-Hawary et al., 2014).
Tumordeteksjon er best i pancreas-parenkymfase ved ca. 40-50 sekunder, mens levermetastaser detekteres best i portovenøs fase ved ca. 70–80 sekunder. Begge faser er viktige for lokal resektabilitetsvurdering. Det er viktig med nok kontrast, ca. 150–180 ml, flow ca. 4 ml/s, og at kontrastmengden kan justeres etter vekt og habitus. Undersøkelsen utføres i multidetektor skanner med helicalt volumopptak med tynne sub-mm snitt. Datasettet kan overføres til egen tolkningsenhet for postprosessering for ulike bilderekonstruksjoner av mesenterialkar og gallegang/pancreasgang. Dokumentasjon med lagring av tynne snitt eller standard 2-3 mm reformater blir så overført til PACS. Ved tilsendte bilder, er det viktig at de tynne sub-mm snittene overføres rekvirende sykehus. To-faseundersøkelse gir tilfredsstillende kartlegging av karanatomien. Dual energy CT kan bl.a. gi bedre deteksjon ved å gjøre subtile pancreaslesjoner bedre synlig og gi bedre vevskarakterisering (George et al., 2017), men er ikke etablert standard ved preoperativ utredning.
Mål for undersøkelsen er:
- Tumordiagnostikk – typisk adenokarsinom eller annet?
- Radiologisk TNM klassifisering
- Karaffeksjon
Duktalt adenokarsinom er typisk karfattig. Både tumor og eventuelle levermetastaser er vanligvis hypodense i forhold til normalt kontrastladende parenkym. Noen få (< 10 %) av adenokarsinomene i pancreas er isodense, og skiller seg ikke fra pancreasparenkymet på CT (Kim et al., 2010). Selv om det ikke identifiseres en sikker lesjon ved CT, kan sekundære forandringer gi mistanke om tumor; slik som dilatasjon av gallegang og pancreasgang, abrupt stenose i pancreasgangen,
parenkymatrofi, endret ytre kontur eller tap av lobulering. Dual energy CT kan gi økt deteksjon (George et al., 2017), og MR og/eller EUS kan være avklarende (Toft et al., 2017)når tumor ikke er identifisert på CT.
Resektabilitetsvurdering. Se under avsnittet "Vurdering av resektabilitet" i kapitlet om kirurgi.
Viktige radiologiske funn i vurderingen av lokal resektabilitet er (Al-Hawary et al., 2014):
- Lokalisasjon og størrelse av tumor.
- Tumors relasjon til omgivende fettvev, organer og blodkar.
- Relasjon til vener og arterier (truncus coeliacus, a. mesenterica superior, a. hepatica communis/propria, v. mesenterica superior, v. portae, aorta, vena cava) skal vurderes spesielt. Karaffeksjon bør beskrives med grad av affeksjon: formendring, okklusjon, tumorkontakt < eller > 180 grader av karets omkrets og lengdeutstrekning i cm, og eventuell avstand fra veneaffeksjon til de proksimale jejunal- og ilealvener (dvs. om det foreligger venestamme proksimalt og distalt på v. mesenterica superior/v. portae som muliggjør venerekonstruksjon).
- Avvik fra normal anatomi (galleveier, blodkar).
Metastaser er vanligst til lymfeknuter, lever og peritoneum, og er ofte små. Ved usikre funn i lever og tvil om levermetastaser hos pasient med ellers resektabel tumor skal det være lav terskel for å gjøre MR lever (Schima et al., 2007). Ved kontraindikasjon mot MR kan gjøres kontrastforsterket ultralyd lever. Det er generelt vanskelig å skille mellom metastatiske og reaktive lymfeknuter. Likevel er det viktig å beskrive grad av bildemessig mistanke om malignitet, om lymfeknutene er lokalisert peripancreatisk eller ikke (i eller utenfor reseksjonsområdet). Ved tvil om peritoneale metastaser vurderes laparoskopi (Allen et al., 2013).
Studier har vist fordeler ved å benytte en strukturert rapport/standardmal ved beskrivelse av pancreaskreft for en standardisert beskrivelse av tumor og for å sikre at man har vurdert og rapportert alle relevante funn som har betydning for staging og eventuell planlegging av kirurgi (Al-Hawary et al., 2014; Dimarco et al., 2020). Av tekniske årsaker kan det være vanskelig å få slike maler inn i PACS/RIS, men standardmalen kan i tilfelle gjerne brukes som huskeliste slik at alle relevante momenter vurderes og beskrives i friteksten. Se vedlegg Forslag til mal for strukturert radiologi rapport av adenokarsinom i pancreas.
Radiologivurdering etter gjennomgått neoadjuvant behandling. Se avsnittet "Radiologi etter gjennomgått kjemoterapi" i kapitlet Onkologisk forbehandling ved lokalisert sykdom.