Neoadjuvant/perioperativ kjemoimmunterapi
Tidligere er det vist at preoperativ (neoadjuvant) kjemoterapi har sammenlignbar effekt som postoperativ (adjuvant) kjemoterapi (Felip et al., 2010). Neoadjuvant behandling med kjemoterapi kombinert med immunterapi hos operable pasienter i stadium IB til IIIA (TNM 7) har i fase III CheckMate 816-studien vist klart høyere grad av patologisk tumorrespons, bedre sykdomsfri og total overlevelse og tilsvarende bivirkningsprofil sammenlignet med kjemoterapi alene (Forde et al., 2022; Forde et al., 2025). I studien ble 358 pasienter (60% i stadium IIIA, og alle uten EGFR-mutasjoner eller ALK-translokasjoner) randomisert 1:1 til 3 sykler platinumdublett med eller uten nivolumab før operasjon. Patologisk komplett respons (ingen gjenværende viable tumorceller i operasjonsresektatet) ble oppnådd hos 24,0 % av kombinasjonsgruppen, mot 2,2 % av de som kun fikk kjemoterapi. Hendelsesfri overlevelse (hendelse definert som progresjon, død, eller ikke gjennomført operasjon) etter 2 år var 63,8 % i kombinasjonsgruppen mot 45,3 % i kjemoterapigruppen (HR 0,63). Alvorlige behandlingsrelaterte bivirkninger (CTCAE grad 3-5) var sett hos 33,5 % i kombinasjonsgruppen og 36,9 % i kjemoterapigruppen, og bivirkninger som ledet til utsatt eller avlyst operasjon oppsto hos 4,5 % i kombinasjongruppen og 5,1 % i kjemoterapigruppen. Flere av de som fikk kombinasjonsbehandling ble operert enn de som fikk kjemoterapi alene (83 % vs. 75 %). Fem-års totaloverlevelse var høyere i kombinasjonsgruppen enn i kjemoterapigruppen (65,4 % vs. 55,0 %). Subgruppeanalyser viste at effekten var større for pasienter i stadium III (HR 0,70) enn for stadium IB-II (HR 0,77). Subgruppeanalyser av pasienter basert på PD-L1-nivå viste best effekt for pasienter med PD-L1-nivå ≥ 1 % (HR 0,51, mot HR 0,89 ved PD-L1 <1 %). Behandlingsregimet er EMA-godkjent for operable pasienter med PD-L1 ≥1 %, stadium II og III (TNM 8) og uten EGFR- og ALK-forandringer.
På basis av CheckMate 816-studien anbefales operable pasienter uten påvist EGFR- eller ALK-forandringer, PD-L1-nivå ≥ 1%, i stadium II og III (TNM 8) å bli vurdert på regionalt MDT-møte for neoadjuvant kjemoimmunterapi. EGFR- og ALK-svar må foreligge før oppstart kjemoimmunterapi. Det gis 3 sykler nivolumab + kjemoterapi med 3 ukers mellomrom, etterfulgt av ny CT-evaluering (PET/CT anbefales ikke her) innen 3 uker etter siste kur og diskusjon på nytt MDT-møte for endelig operabilitetsvurdering. Operasjon bør gjøres innen 6 uker etter 3. kjemoimmunterapikur. For pasienter med ikke-plateepitelkarsinom anbefales kjemoterapikombinasjonen karboplatin (AUC 5) og pemetreksed (500 mg/kvm dag 1). Vitamin B12 og folsyre skal være startet minst 5 dager før første kur. For plateepitelkarsinomer anbefales karboplatin (AUC 5) og gemcitabin (1000 mg/kvm dag 1+8). Karboplatin kan eventuelt erstattes med cisplatin (75 mg/m2) uansett histologi, men både i Checkmate 816 og den senere publiserte Checkmate 77T-studien (perioperativ kjemoimmunterapi) (Cascone et al., 2024) synes effekten å være best hos pasienter som mottok karboplatin. Karboplatin (AUC 5) og paklitaksel (175 mg/kvm) kan være et alternativ uavhengig av histologi. Nivolumab doseres med 360 mg og gis samtidig med cellegift dag 1. Ved neutropeni grad 4 (nadir < 0,5 x109) bør kjemoterapidosen reduseres, og G-CSF kan vurderes ved neste kur(er).
Beslutningsforum vedtok 12.2.2024 følgende:
- Nivolumab (Opdivo) i kombinasjon med platinumbasert kjemoterapi innføres til neoadjuvant behandling av operabel ikke-småcellet lungekreft (NSCLC) med høy risiko for tilbakefall hos voksne pasienter hvor tumorer har PD-L1-ekspresjon ≥ 1%.
- Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
- Behandlingen kan tas i bruk fra beslutningstidspunktet
Flere studier med tilsvarende design, men hvor også immunterapi i inntil 1 år etter operasjon er del av behandlingen, har blitt gjennomført. Den såkalte AEGEAN-studien randomiserte 802 operable pasienter uten EGFR-/ALK-mutasjon i stadium II til IIIB (TNM 8) til 4 preoperative kurer platinumbasert kjemoterapi med enten durvalumab eller placebo hver 3. uke, etterfulgt postoperativt av inntil ett år durvalumab eller placebo hver 4. uke (Heymach et al., 2023). Hendelsesfri overlevelse (hendelse definert som tilbakefall, død eller manglende kirurgi) etter 1 år var 73,4 % hos pasenter som fikk durvalumab mot 64,5 % hos dem som fikk placebo. Totaloverlevelsestall foreligger ikke. Bivirkninger grad 3-4 forekom hos 42,4 % i durvalumabgruppen, mot 43,2 % i placebogruppen. Subgruppeanalyser basert på PD-L1-nivå viste at hasardratio for hendelsfri overlevelse var 0,76, 0,70 og 0,60 for PD-L1-nivåer <1 %, 1-49 % og ≥ 50%, og 95 % konfidensintervall krysset 1 for alle subgrupper.
I denne studien ble det sammen med durvalumab 1500 mg gitt pemetreksed (500 mg/kvm) med enten karboplatin (AUC 5) eller cisplatin (75 mg/kvm) ved ikke-plateepitelkarsinom, og enten gemcitabin (1250 mg/kvm dag 1+8) med cisplatin (75 mg/kvm) eller paklitaksel (200 mg/kvm) med karboplatin (AUC 6) ved plateepitelkarsinom. Karboplatin AUC 5 kan nok erstatte både cisplatin 75 mg/kvm og karboplatin AUC 6. Merk at samme dose durvalumab (1500 mg) gis hver 3. uke preoperativt (sammen med kjemoterapi), og hver 4. uke postoperativt (som monoterapi).
Beslutningsforum vedtok 28.4.2025 følgende:
- Durvalumab (Imfinzi) innføres i kombinasjon med platinabasert kjemoterapi som neoadjuvant behandling, etterfulgt av IMFINZI som monoterapi som adjuvant behandling, til behandling av voksne med resekterbar NSCLC med høy risiko for tilbakefall og ingen EGFR-mutasjoner eller ALK-rearrangering.
- Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
- Behandlingen kan tas i bruk fra beslutningstidspunktet.
I Keynote 671-studien ble 797 operable pasienter uten EGFR-/ALK-mutasjon i stadium II til IIIb (TNM 8) randomisert til 4 preoperative kurer kjemoterapi (cisplatin-kombinasjon) med enten pembrolizumab eller placebo, etterfulgt postoperativt av inntil 13 sykler med pembrolizumab eller placebo hver 3. uke (Wakelee et al., 2023). I en oppdatert analyse etter median 36,6 mndr oppfølgningstid var 36-mndrs totaloverlevelse 71 % i pembrolizumabgruppen og 64 % i placebogruppen (p=0,0052) (Spicer et al., 2024). Median hendelsesfri overlevelse var 47,2 mndr i pembrolizumab-gruppen, mot 18,3 mndr i placebogruppen. Subgruppeanalyser basert på PD-L1-nivå viste at hasardratio for hendelsfri overlevelse hos pasienter med PD-L1-utrykk under 1 % var 0,75 (95 % KI 0,56-1,01), mot 0,51 (95 % KI 0,39-0,66 ved PD-L1 ≥ 1%. For totaloverlevelse (mindre modne tall) var tilsvarende hasardratio-tall 0,91 (0,63-1,32) og 0,62 (0,45-0,87).
I denne studien ble det sammen med pembrolizumab enten 200 mg hver 3. uke eller 400 mg hver 6. uke gitt cisplatin (75 mg/kvm) og pemetreksed (500 mg/kvm dag) ved ikke-plateepitelkarsinom, og cisplatin (75 mg/kvm) og gemcitabin (1000 mg/kvm dag 1+8) for plateepitelkarsinom. Også her kan man nok erstatte cisplatin med karboplatin AUC 5.
Beslutningsforum vedtok 28.4.2025 følgende:
- Pembrolizumab (Keytruda) innføres i kombinasjon med platinabasert kjemoterapi som neoadjuvant behandling, etterfulgt av monoterapi som adjuvant behandling til voksne pasienter med operabel ikke-småcellet lungekreft med høy risiko for tilbakefall.
Følgende vilkår gjelder: Behandlingen skal kun brukes til behandling av pasienter med PD-L1-uttrykk under 1 % uten påviste genforandringer i EGFR eller ALK.
- Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
- Behandlingen kan tas i bruk fra beslutningstidspunktet.
I CheckMate 77T-studien ble 461 operable pasienter uten EGFR-/ALK-mutasjon i stadium II til IIIB (TNM 8) randomisert til 4 preoperative kurer kjemoterapi (platin-kombinasjon) med enten nivolumab eller placebo, etterfulgt postoperativt av 1 års behandlling med nivolumab eller placebo hver 4. uke (Cascone et al., 2024). I en interimanalyse etter median 25,4 mndr oppfølgningstid var 18-mndrs hendelsesfri overlevelse 70,2 % i nivolumabgruppen og 50,0 % i placebogruppen (p<0,001). Effekten var tydeligst i gruppen med PD-L1-nivå ≥ 1 % (HR 0,52, mot HR 0,73 ved PD-L1 < 1 %. Grad 3- eller 4-bivirkninger oppsto hos 32,5 % av nivolumab-behandlede pasienter mot 25,2 % av de som kun hadde fått kjemoterapi. Totaloverlevelsestall er foreløpig ikke modne.
Beslutningsforum vedtok 16.6.25 følgende:
- Nivolumab (Opdivo) innføres i kombinasjon med platinabasert kjemoterapi som neoadjuvant behandling, etterfulgt av nivolumab (Opdivo) som monoterapi som adjuvant behandling, for behandling av operabel ikke-småcellet lungekreft med høy risiko for tilbakefall hos voksne pasienter med tumorer med PD L1 ekspresjon ≥ 1 %.
- Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
- Behandlingen kan tas i bruk fra beslutningstidspunktet.
Det er ingen studier som formelt har testet om postoperativ immunterapi gir tilleggseffekt utover neoadjuvant kjemoimmunterapi. Langvarig immunterapi gir økt kumulativ risiko for alvorlige bivirkninger. Inntil positive data på nytten av postoperativ immunterapi foreligger, er det derfor grunnlag for å anbefale kun neoadjuvant behandling til pasienter med PD-L1-nivå ≥ 1 %. For pasienter med PD-L1-negativ sykdom er gevinsten av immunterapi usikker og sannsynligvis liten. Studien med pembrolizumab bekrefter overlevelsegevinst for totalgruppen, mens AEGEAN- og 77T-studiene foreløpig har umodne overlevelsesdata. Beslutningsforum har vedtatt at nivolumab kun kan benyttes ved PD-L1-postiv sykdom, durvalumab kan benyttes uavhengig av PD-L1-uttrykk, mens pembrolizumab kun kan benyttes ved PD-L1-negativ sykdom. På bakgrunn av foreliggende data synes det å være grunnlag for å foretrekke pembrolizumab framfor durvalumab for pasienter med PD-L1-negativ sykdom. Seks-ukers intervall kan være alternativ til tre-ukers intervall i postoperativ fase. Perioperativ behandling med durvalumab kan være et alternativ uavhengig av PD-L1-status. En oppsummering av systemisk behandling for operable pasienter vises i Figur 15.
En oversikt over behandlingsforløpet for pasienter som er aktuelle for neoadjuvant eller adjuvant behandling er vist i Figur 16.
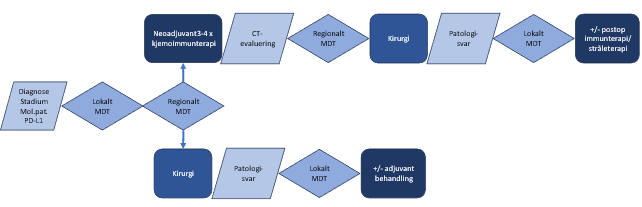
Anbefaling – neoadjuvant/perioperativ kjemoimmunterapi
- Operable pasienter i stadium II og III kan vurderes for neoadjuvant, eventuelt perioperativ kjemoimmunterapi:
- Svulster med PD-L1-uttrykk ≥ 1 %, og er EGFR- og ALK-negative, vurderes for kun neoadjuvant behandling: Det gis 3 kurer nivolumab og platinumdublett med 3 ukers mellomrom.
- Svulster med PD-L1-uttrykk <1 %, og er EGFR- og ALK-negative, kan vurderes for perioperativ behandling: Det gis pembrolizumab 2 kurer 400 mg eller 4 kurer 200 mg og platinumdublett med 3 ukers mellomrom preoperativt, og inntil 39 uker pembrolizumab hver 3. eller hver 6. uke postoperativt.
- Perioperativ behandling med durvalumab kan være et alternativ uavhengig av PD-L1-status, mens perioperativ behandling med nivolumab kan være et alternativ ved PD-L1-positiv sykdom.
- Det skal tas ny CT 2-3 uker etter siste preoperative kur, og pasienten vurderes på nytt regionalt MDT-møte.
- Operasjon bør gjøres innen 6 uker etter siste preoperative infusjon.
Adjuvant kjemoterapi
Pasienter som har gjennomført neoadjuvant kjemoimmunterapi anbefales ikke adjuvant kjemoterapi. Dersom neoadjuvant behandling ikke er gitt, kan adjuvant kjemoterapi tilbys til pasienter med samme svulstkategorier som nevnt over (stadium II og III) basert på studier og metaanalyser som har vist gevinst i størrelsesorden 5-15 % økt 5-årsoverlevelse sammenlignet med kirurgi alene (Pignon et al., 2008; Winton et al., 2005). Effekt er ikke vist for pasienter med svulster under 4 cm uten lymfeknutemetastaser. Cisplatin/pemetreksed anbefales for pasienter med ikke-plateepitelkarsinom, mens cisplatin/vinorelbin anbefales for pasienter med plateepitelkarsinom (Kenmotsu et al., 2020; Kreuter et al., 2013). Karboplatin kan eventuelt erstatt cisplatin, spesielt hos eldre (Cuffe et al., 2012). Det gis inntil fire kurer.
I studiene ble adjuvant kjemoterapi anbefalt startet innen 8 uker, men det er også data som tyder på at senere start (opp til 4 måneder postoperativt) gir forbedret prognose sammenlignet med ingen adjuvant behandling (Salazar et al., 2017). Det er lite evidens for nytte av vekstfaktorstøtte (G-CSF), men dette kan eventuelt vurderes ved nøytropeniproblematikk som vanskeliggjør opprettholdelse av doseintensitet (Genova, Rijavec, & Grossi, 2016).
Ved storcellet nevroendokrint karsinom anbefales adjuvant kjemoterapi også ved stadium IB, med cisplatin/etoposid (se avsnitt "Medikamentell behandling" i Storcellet nevroendokrint karsinom (LCNEC)).
Immunterapi som adjuvant behandling
Hos pasienter med PD-L1-nivå ≥ 50 % som ikke har fått neoadjuvant kjemoimmunterapi, og som tilbys adjuvant kjemoterapi, kan også immunterapi tilbys. Dette er basert på en fase III studie (IMpower 010) som viste at 1 års behandling med atezolizumab (1200 mg iv hver 3. uke i inntil 1 år) økte 3-års sykdomsfri overlevelse hos pasienter i stadium II-IIIA og med PD-L1-uttrykk ≥ 50 % til 89,1 % hos de som hadde fått atezolizumab, mot 77,5 % i kontrollgruppen (HR 0,42) (Felip et al., 2021). Bivirkningsprofilen var som forventet ved immunterapi. Totaloverlevelsesdata er foreløpig umodne. Dette behandlingsregimet ble vurdert i Beslutningsforum 25.09.23 med følgende vedtak:
«Atezolizumab (Tecentriq) innføres som monoterapi til adjuvant behandling etter fullstendig reseksjon og platinabasert kjemoterapi av voksne pasienter med ikke-småcellet lungekreft (NSCLC) med høy risiko for tilbakefall der tumor har PD-L1-ekspresjon i ≥ 50 % av tumorcellene (TC) og som ikke har EGFR-mutant eller ALK positiv NSCLC.
Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
Behandlingen kan tas i bruk fra beslutningstidspunktet.»
Adjuvant målrettet behandling
Opererte med EGFR-mutasjon
Pasienter med operert EGFR-mutert ikke-småcellet lungekreft vil kunne ha nytte av adjuvant behandling med EGFR-hemmeren osimertinib. Det er publisert en fase III-studie som randomiserte 682 opererte pasienter i stadium IB-IIIA (TNM 7) med enten delesjon i ekson 19 eller punktmutasjonen L858R til 3 års behandling med enten placebo eller osimertinib 80 mg x1 p.o. (Y. L. Wu et al., 2020). Pasientene kunne ha fått standard adjuvant kjemoterapi før randomisering. Sykdomsfri overlevelse to år etter randomisering var markert bedre i gruppen som fikk osimertinib (89 %) sammenlignet med placebogruppen (52 %). Forskjellen var tydeligst hos pasienter som hadde sykdomsstadium II eller III (HR 0,17). Effekten var også signifikant i IB-gruppen (T-størrelse >3-5 cm, N0) med 4-års sykdomsfri overlevelse HR 0,41. Senere oppdatering har vist tilnærmet lik effekt for stadium IB i henhold til TNM 8 (n =199, T-størrelse > 3-4 cm, N0) med HR 0,44 (Herbst et al., 2023). Sannsynligheten for utvikling av hjernemetastaser var tydelig lavere i gruppen som fikk osimertinb (HR 0,24). Totaloverlevelsestallene er i favør osimertinib-behandling, med 5-årsoverlevelse på 88 % i osimertinibgruppen mot 78 % i placcebogruppen (Tsuboi et al., 2023), men det er verdt å kommentere at kun 42 % av pasientene i placebogruppen fikk osimertinib ved progresjon. Det var ingen forskjell i sykdomsfri overlevelse hos osimertinib-behandlede pasienter som hadde fått, eller ikke fått, adjuvant kjemoterapi før oppstart osimertinib. Det er derfor ikke opplagt at det er grunnlag for å gi kjemoterapi, men siden vi har langtidsoverlevelsesdata som viser signifikant positiv effekt av slik behandling er det trolig fornuftig å ikke utelate denne behandlingen til pasienter hvor dette kan være aktuelt (stadium II-III, god allmenntilstand).
Osimertinib som adjuvant behandling ble vurdert i Beslutningsforum 29.08.22 med følgende vedtak:
«Osimertinib (Tagrisso) som monoterapi innføres til adjuvant behandling etter fullstendig tumorreseksjon hos voksne med stadium IB-IIIA ikke-småcellet lungekreft (NSCLC) der tumor har epidermal vekstfaktor-reseptor (EGFR) ekson 19-delesjoner eller ekson 21 (L858R) substitusjonsmutasjoner.
Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
Behandlingen kan tas i bruk fra beslutningstidspunktet.»
Opererte med ALK-translokasjon
Pasienter med operert ALK-translokert ikke-småcellet lungekreft vil kunne ha nytte av adjuvant behandling med ALK-hemmeren alektinib. Det er publisert en fase III-studie (ALINA-studien) som randomiserte 257 opererte pasienter i stadium IB-IIIA (TNM 7) med påvist ALK-translokasjon til 2 års behandling med enten standard adjuvant kjemoterapi eller alektinib 600 mg x2 p.o. (Wu et al., 2024). Pasientene i alektinib-armen fikk ikke adjuvant kjemoterapi. Sykdomsfri overlevelse to år etter randomisering var markert bedre i gruppen som fikk alektinib (93,6 %) sammenlignet med kjemoterapigruppen (63,7 %, HR 0,24). Forskjellen var lik hos pasienter som hadde sykdomsstadium II eller III (HR 0,24). Sannsynligheten for utvikling av hjernemetastaser var også lavere i gruppen som fikk alektinib (CNS-sykdomsfri overlevelse etter 2 år var 98,4 % i alektinibgruppen mot 85,8 % i kjemoterapitgruppen, HR 0,22). Totaloverlevelsestallene er foreløpig umodne. Det var omtrent likt antall grad 3- og 4-bivirkninger i begge grupper (29,7 % for alektinibbehandlede og 30,8 % for kjemoterapibehandlede. Dosereduksjon og seponering pga bivirkninger forekom hos henholdsvis 25,8 % og 5,5 % av alektinibbehandlede pasienter.
Alektinib som adjuvant behandling ble vurdert i Beslutningsforum 18.11.24 med følgende vedtak:
«Alektinib (Alecensa) innføres som monoterapi til adjuvant behandling etter fullstendig tumorreseksjon hos voksne pasienter med ALK-positiv ikke-småcellet lungekreft (NSCLC) med høy risiko for tilbakefall.
Det forutsetter at prisen er lik eller lavere enn den prisen som er grunnlaget for denne beslutningen.
Behandlingen kan tas i bruk fra beslutningstidspunktet.»
Anbefaling – adjuvant medikamentell behandling
- Opererte pasienter i stadium II og III som ikke har fått neoadjuvant kjemoimmunterapi gis fire kurer cisplatin + pemetreksed (ikke-plateepitelkarsinom) eller cisplatin + vinorelbin (plateepitelkarsinom, eller dersom pemetreksed ikke kan gis). Cisplatin kan erstattes med karboplatin.
- Start innen åtte uker fra operasjonstidspunkt.
- Aktuelt hos pasienter ≤70 år i god allmenntilstand (ECOG 0-1). Kan også vurderes hos eldre pasienter uten vesentlig skrøpelighet og i god allmenntilstand
- I tillegg til kjemoterapi tilbys atezolizumab i 1 år ved PD-L1-uttrykk ≥ 50%, men ikke ved EGFR-mutasjon eller ALK-translokasjon.
- Radikalopererte pasienter i stadium II til III med påvist EGFR-mutasjon (delesjon i ekson 19 eller L858R) bør vurderes for adjuvant behandling i inntil 3 år med osimertinib. Kjemoterapi (men ikke immunterapi) før oppstart EGFR-TKI vurderes gitt til disse etter vanlige rutiner.
- Radikalopererte pasienter i stadium II til III med påvist ALK-translokasjon bør vurderes for adjuvant behandling i inntil 2 år med alektinib, uten forutgående kjemoterapi.
Adjuvant behandling etter steretotaksi
Adjuvant kjemoterapi før eller etter stereotaktisk stråleterapi er ikke analysert i prospektive studier. En publisert stor retrospektiv analyse viste at for pasienter i stadium T1-T3N0M0 var overlevelsen dårligere blant pasienter som hadde fått adjuvant kjemoterapi sammenlignet med ingen adjuvant behandling (Foster et al., 2019). En annen, mindre studie fant en lengre tid til residiv, men ingen bedret totaloverlevelse, blant pasienter som hadde fått adjuvant kjemoterapi (Kann et al., 2019). Det synes derfor rimelig å være varsom med adjuvant kjemoterapi etter stereotaksi, men slik behandling kan kanskje vurderes hos pasienter som er i god form (der stereotaksi er valgt pga pasientens ønske, og ikke pga medisinsk inoperabilitet), har stor svulst (>4 cm) og kjent histologi.
Anbefaling – adjuvant behandling etter stereotaksi for stadium I/II
- Rutinemessig adjuvant behandling er ikke aktuelt etter stereotaktisk stråleterapi.