Preoperative vurderinger
Vurderingen fordrer oppdatert bildediagnostikk, leverfunksjonsprøver, informasjon om underliggende leversykdom (viral sykdom, alkohol), komorbiditet, funksjonsnivå (ECOG) og pasientens preferanser.
Bildediagnostikk
Som et minimum av utredning for kirurgi bør det foreligge CT-thorax og flerfase CT-lever/abdomen (se kapittelet Bildediagnostikk). Supplerende MR-lever med kontrast bør også gjennomføres så raskt som mulig hos potensielle reseksjonskandidater.
Leverfunksjon
Se kapittelet Utredning og diagnostikk. Ved mistanke om cirrhose og/eller redusert leverfunksjon, bør Child Pugh-skår beregnes, ev. også supplert med MELD-Na-skår og ALBI-skår. Anbefalte laboratorieprøver inkluderer INR, bilirubin, albumin, natrium, kreatinin og AFP. I tillegg kan gastromedisinsk utredning vurderes med eksempelvis transient elastografi og eventuelt leverbiopsi. Hvis funksjonen i framtidig leverrest mistenkes å være redusert, kan denne estimeres med nukleærmedisinsk funksjonsvurdering (99Tc-mebrofeninscan) der en verdi under 2.7 %/min/m2 indikerer signifikant redusert funksjon (de Graaf et al., 2010).
Portal hypertensjon
I noen tilfeller der det mistenkes klinisk signifikant portal hypertensjon, uten at dette er åpenbart ut fra kliniske og radiologiske funn, kan invasiv trykkgradientmåling (levervene – portvene) vurderes. Innkilt trykkgradient (Hepatic Venous Pressure Gradient, HVPG) angis som differansen mellom innkilt venetrykk (tilsvarer portvenetrykket) og trykket i vena cava inferior. Målingen utføres perkutant med transjugulær tilgang.
Levervolum
Ved større formelle reseksjoner er det nødvendig å evaluere fremtidig leverrest (FLR). Volumet kan beregnes i forhold til kroppsoverflate (BSA) og angis som en standardisert verdi (sFLR) jfr. Vautheys formel (Vauthey et al., 2002). Adekvat restvolum er direkte avhengig av estimert funksjon (se kap. 6.1.2.2).
Operabilitetskriterier
Cirrhotisk eller ikke-cirrhotisk lever
Ved vurdering for reseksjon er det viktig å skille mellom lever med og uten cirrhose. I en ikke-cirrhotisk lever med solitær tumor er kirurgi førstevalg, men ablasjon kan vurderes ved små og/eller sentrale lesjoner. I Norge har andelen av pasienter med HCC i ikke-cirrhotisk lever vært noe høyere enn i resten av verden, men den er avtagende (Eskesen et al., 2014). Kirurgi ved HCC og levercirrhose forutsetter i regelen godt kompensert funksjon (Child-Pugh A) og begrenset sykdom. Ved levercirrhose og små lesjoner (2-3 cm), kan ablasjon være et jevngodt alternativ til kirurgisk reseksjon (Shindoh et al., 2013), og ofte være førstevalg hos pasienter med klinisk portal hypertensjon.
Nødvendig restvolum
Større formelle reseksjoner kan vurderes gjennomført med akseptabel risiko dersom sFLR beregnes til > 30 % (ikke-cirrhotisk lever) eller > 40 % (cirrhotisk lever). Hvis restvolum ikke er tilstrekkelig, kan pasienten vurderes for volumekspanderende tiltak (portvene-embolisering) eller transplantasjon.
Leverens evne til å hypertrofiere (kinetisk veksthastighet, kinetic growth rate - KGR) estimeres med CT-kontroll to uker etter emboliseringen, og benevnes KGR2w (Shindoh et al., 2013). En KGR på > 2 prosentpoeng/uke anses å indikere god vekstfunksjon.
Portal hypertensjon: implikasjoner
Portal hypertensjon er en relativ kontraindikasjon mot reseksjon. HVPG > 5 mm Hg er patologisk, og gradient > 10-12 mm Hg innebærer signifikant økt risiko for perioperative komplikasjoner og mortalitet (10 %) (Azoulay et al., 2021). Kirurgi ved høyere trykk enn dette krever særskilt vurdering og bør kun gjøres i protokoll.
Pågående alkohol- og/eller annet rusmisbruk
Dette utgjør i utgangspunktet en klar kontraindikasjon mot reseksjon.
Aktiv hepatitt og antiviral behandling
Kirurgi bør utsettes noe ved ubehandlet virushepatitt. Antiviral behandling må starte umiddelbart, og leverkirurgi kan gjøres etter noen ukers behandling.
Multifokalitet og tumorstørrelse
Ifølge BCLC-kriteriene begrenses indikasjonen for reseksjon til pasienter med solitære svulster og sykdomsstadiene BCLC-0 (very early stage) og BCLC-A (early stage), mens pasienter med 2-3 lesjoner (alle < 3 cm), også BCLC-A, bør vurderes for ablasjon eller transplantasjon fremfor reseksjon. Det finnes imidlertid mange publikasjoner som viser at pasienter utenfor både BCLC- og Milan-kriteriene kan oppnå akseptabel langtidsoverlevelse etter reseksjon (Garancini et al., 2018; Tsilimigras, 2020; Zaydfudim et al., 2016). I en systematisk oversikt med 23 artikler og 2412 pasienter med multifokal sykdom var antall svulster avgjørende for 5-års overlevelse; ≤ 3 svulster: 49 % vs. > 3 svulster: 23 % (Glantzounis et al., 2018). En multisenterstudie med 1066 pasienter med levercirrhose viste 5-års overlevelse: ≤ 2 svulster: 58 % vs. > 2 svulster: 35 % (Li et al., 2019). Total tumorbyrde (størrelse og antall) kan bidra til å predikere overlevelse (Tsilimigras, 2020). Pasienter med begrenset multifokal sykdom og tumorstørrelse noe utover BCLC-kriteriene, kan ha overlevelsesgevinst etter reseksjon, eventuelt i kombinasjon med ablasjon, så lenge kirurgi er teknisk gjennomførbart med tanke på restvolum, portalt trykk og leverfunksjon. Slike reseksjoner bør fortrinnsvis gjøres i protokoll. Pasientgruppen er heterogen og må diskuteres individuelt og multidisiplinært for å oppnå best tilpasset behandling (Glantzounis et al., 2018; Koh et al., 2018; Ruff et al., 2020; Tsilimigras, 2020).
Makrovaskulær invasjon
Tumortromber i portas hovedstamme og tromber som vokser inn i vena cava inferior er absolutte kontraindikasjoner for kirurgi, selv om noen serier med resecerte tromber i vena cava er publisert fra Asia. Reseksjon av svulster med mer perifere tumortromber kan vurderes for kirurgi i selekterte tilfeller, og da helst i protokoll (Glantzounis et al., 2018).
Ekstrahepatisk spredning
Som hovedregel er funn av ekstrahepatisk metastasering et ekslusjonskriterium for kirurgisk reseksjon.
Kirurgisk teknikk og tilgang
Laparoskopisk tilgang har i flere serier vist sammenlignbare resultater med åpen teknikk med tanke på overlevelse. Randomiserte studier (laparoskopisk vs. åpen teknikk) med langtidsoverlevelse som endepunkt er ikke publisert. Imidlertid er det i flere case-control-studier og meta-analyser vist at minimalinvasiv leverkirurgi medfører mindre intraoperativt blodtap, lavere transfusjonsrate, færre liggedøgn og raskere postoperativ rekonvalesens uten å kompromittere reseksjonsmarginer eller radikalitet (El-Gendi et al., 2018; Hendi et al., 2021). Hos pasienter med cirrhose anses det også viktig å bevare bukveggens integritet i størst mulig grad, og minimalinvasiv tilgang kan bidra til dette.
Anatomisk vs. ikke-anatomisk reseksjon er omdiskutert. På den ene siden vil en ved anatomisk reseksjon kunne oppnå god margin og ta med portvenesirkuasjonen i det tumoraffiserte området av leveren for å forhindre tilbakefall, på den andre siden vil det redusere FLR og øke risiko for postoperativ leversvikt.
Frie reseksjonsmarginer tilstrebes. Dersom tumor ligger inntil intrahepatiske strukturer som innebærer at kirurgi øker risiko for postoperativ leversvikt, aksepteres R1-margin mot kar og galleveier, så lenge det ikke foreligger tegn til invasiv vekst (vaskulær R1).
Levertransplantasjon
Begrenset organtilgang gjør at levertransplantasjon generelt sett bare kan tilbys pasienter som tilfredsstiller definerte seleksjonskriterier. Kriteriene skal på gruppenivå kunne predikere en overlevelse etter transplantasjon som er sammenlignbar med den som oppnås for de fleste som blir levertransplantert. Alder, komorbiditet og forventet levetid vil påvirke beslutningen uavhengig av eventuell indikasjon for levertransplantasjon. Det er ikke spesifikke absolutte aldersgrenser, men sannsynligheten for prioritet til transplantasjon vil på grunn av de ovenfor nevnte begrensninger være redusert ved alder vel over 70 år, og spesielt dersom det foreligger samtidig sykdom som forventes å påvirke leveutsikten generelt.
Levertransplantasjon er indisert ved HCC i relativt tidlig fase og er spesielt velegnet ved samtidig leversykdom (Child B+C). Transplantasjon utgjør den optimale behandling ved HCC i cirrhotisk lever, da behandlingen fjerner svulstene samtidig som den underliggende årsaken elimineres. Begrensninger i tilgjengelige donorgraft gjør imidlertid at pasienter med resektable HCC i hovedregel skal tilbys leverreseksjon. Ekstrahepatisk tumorsykdom og makrovaskulær invasjon (annet enn segmentalgrener (Vp1)) er absolutte kontraindikasjoner. Tilbakefall etter transplantasjon kommer vanligvis innen de første to år etter transplantasjonen og er assosiert med meget dårlig prognose. Hensikten med transplantasjonskriteriene er derfor å selektere pasienter med liten risiko for tilbakefall. Størrelse og antall lesjoner brukes som surrogatmarkør for stadium, og alfaføtoprotein (AFP) i serum er en viktig markør for tumorbiologi.
Oslo-kriteriene er noe videre enn de opprinnelige Milan-kriteriene, som danner grunnlag for transplantasjon-seleksjonen i BCLC-algoritmen og er basert på data fra metroticket-prosjektet (http://www.hcc-olt-metroticket.org) og det tilstrebes en estimert 5-års overlevelse på > 60% (Mazzaferro et al., 2018).
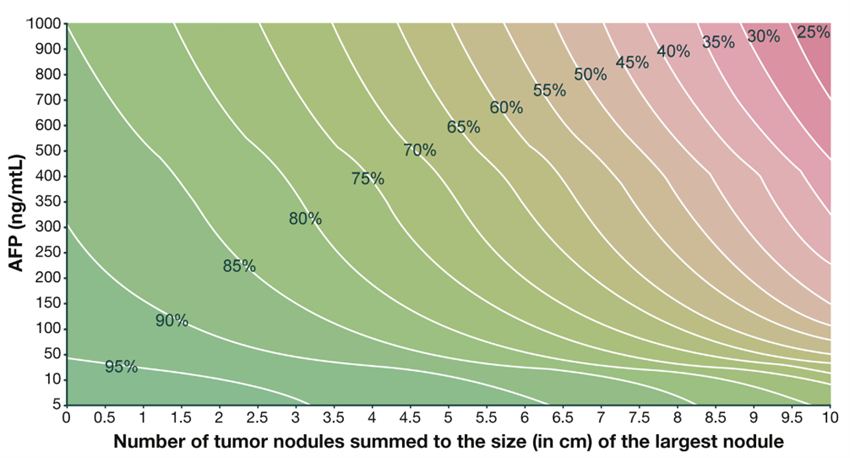
Hovedkriterier
Følgende radiologisk baserte morfologiske kriterier for omfang av sykdom kan godkjennes for levertransplantasjon hos pasienter som har AFP < 400:
Sum av antall lesjoner og største diameter (i cm) ≤ 7 (up-to-seven criteria) (Mazzaferro et al., 2009), eller
En tumor opptil 6,5 cm, eller opptil 3 lesjoner der den største er 4,5 cm og samlet tumordiameter ≤ 8 cm (UCSF-criteria) (Yao et al., 2001).
Nedgradering (downstaging) av tumorsykdom
Pasienter med morfologisk tumoraffeksjon i lever utenfor disse kriteriene (flere lesjoner/større diameter på største lesjon og/eller AFP > 400) må gjennomgå nedgradering etter protokoll (Yao et al., 2008; Yao et al., 2015). Aktuelle modaliteter for nedgradering er transarteriell kjemoembolisering (TACE), transarteriell radioterapi (TARE) eller stereotaktisk strålebehandling (SBRT) (Wong et al., 2021). Denne behandlingen kan eventuelt kombineres med ablasjon (radiofrekvens eller mikrobølger), men ablasjon alene kan ikke brukes som nedgradering og vil i så tilfelle kreve residivfri observasjonstid på ca. 12 måneder etter prosedyren. Dersom man oppnår objektiv respons med systemisk behandling, vil mulighet for lokalbehandling også kunne revurderes.
Radiologisk respons etter forsøk på nedgradering skal vurderes etter modifiserte RECIST kriterier (mRECIST) der maksimal diameter av kontrastladende vev måles for hver lesjon, og manglende kontrastoppladning er tegn på komplett respons, se vedlegg 5.
Omfang av tumorsykdom etter avsluttet nedgraderingsterapi bør være innenfor up-to-seven- eller UCSF-kriteriene, som beskrevet i kap. 6.1.4.1.
AFP må etter nedgradering være < 400.
Etter endt nedgradering bør pasienten observeres i 3 mnd. før listing for transplantasjon, men i ett år etter ablasjon eller SBRT.
Det kan vurderes å gi TKI eller atezolizumab og bevacizumab i ventetiden på transplantasjon.