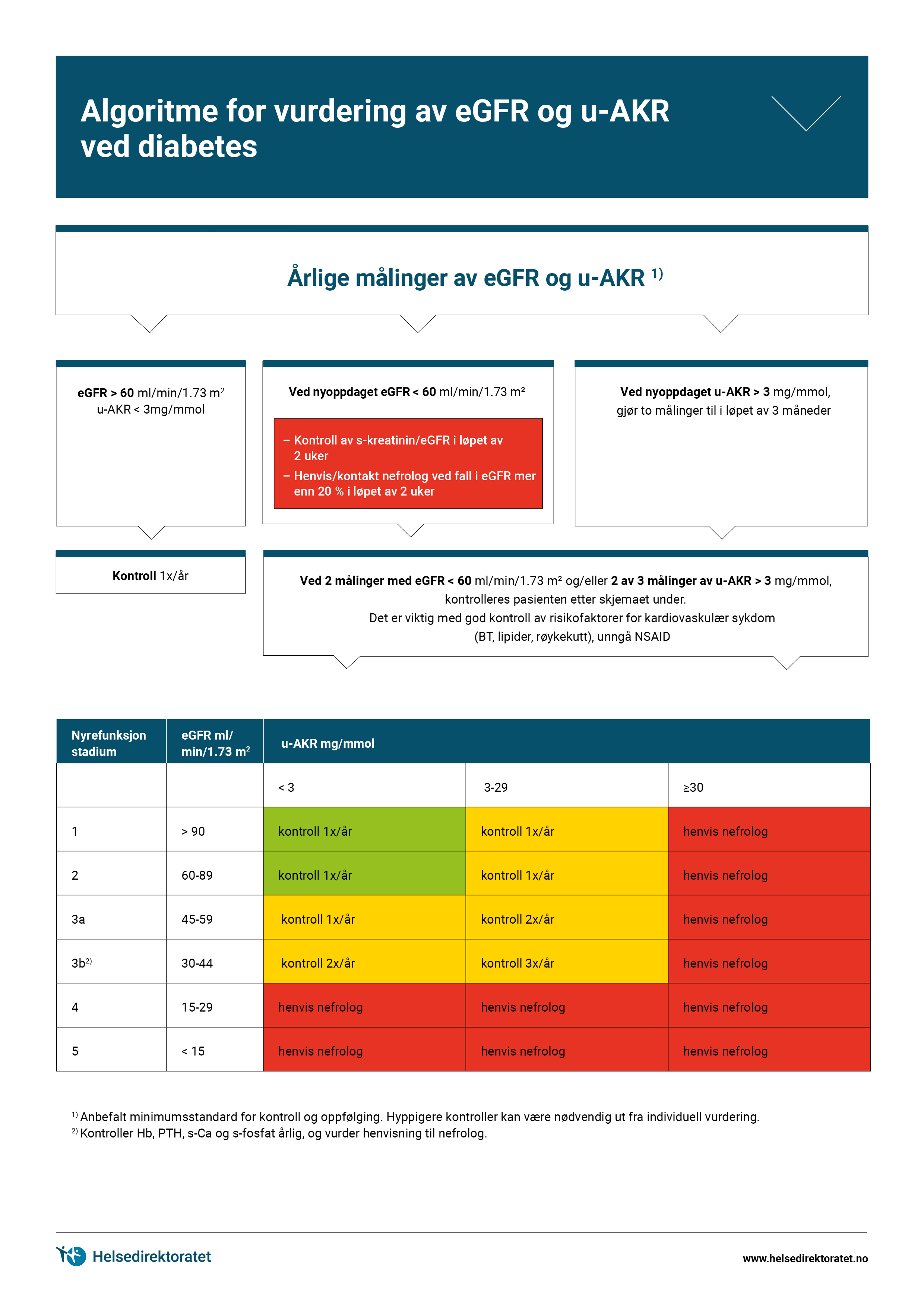
Last ned flytdiagram: Vurdering av eGFR og u-AKR ved diabetes mellitus (Utskriftsvennlig PDF)
Diabetisk nefropati defineres klinisk ved forekomst av urin albumin/kreatinin-ratio (U-AKR) > 30 mg/mmol). Mistanken forsterkes når pasienten samtidig har retinopati. GFR kan være normal eller nedsatt.
| u-AKR | Albuminutskillelse |
| < 3mg/mmol | Normal albuminutskillelse |
| 3-29mg/mmol | Moderat albuminuri* |
| 30-299 mg/mmol | Betydelig albuminuri** |
| ≥ 300mg/mmol | Nefrotisk proteinuri |
* 3-29 mg/mmol er tidligere benevnt som mikroalbuminuri
** 30-299 mg/mmol er tidligere benevnt som makroalbuminuri
Dersom u-AKR måles forhøyet, tas ny prøve innen 3 måneder. Dersom denne også er forhøyet, har pasienten forhøyet u-AKR. Dersom prøve nr 2 har normal albuminutskillelse tas prøve nr 3. Hvis 2 av 3 prøver har forhøyet u-AKR, har pasienten forhøyet u-AKR. Akuttfase og urinveisinfeksjon må utelukkes og kraftig fysisk aktivitet må unngås 3 døgn før testing.
En systematisk oversiktsartikkel (McTaggart et al., 2014) viser at kvantitativ AKR måling vha POC instrument har sensitivitet og spesifisitet for albuminuri på 96 og 98% sammenlignet med AKR målinger gjort på sykehuslaboratorium. Sensitiviteten og spesifisiteten ved bruk av semikvantitative metoder var betydelig dårligere (hhv 76 og 93%) og slike metoder anbefales derfor ikke.
Utskillelsen av albumin i urin kan kvantiteres ved ulike prosedyrer. Tidligere ble ofte ulike urinsamlinger anbefalt (4-24 timer), mens i dag anbefaler de aller fleste retningslinjer at man skal kvantitere AKR i en spotprøve tatt om morgenen. Bruk av morgenurin kan være tungvint, og tilfeldig urin kan benyttes som alternativ.
Ved tolkning av resultater vil grensene variere noe mellom laboratorier pga bruk av ulike metoder, men som tommelfingerregel kan man si at AKR verdier ≥ 3 mg/mmol kreatinin regnes som moderat albuminuri mens verdier ≥ 30 mg/mmol kreatinin regnes som betydelig albuminuri. Enkelte pasientnære apparater på legekontor kvantiterer ikke AKR over en viss terskelverdi, de viser kun en verdi «større enn»: det vil si >. I slike tilfeller bør man sende inn prøven til et sentrallaboratorium for en nøyaktig verdibestemmelse.
Ved tolkning av flere påfølgende resultater bør man være klar over at utskillelse av albumin i urin viser stor biologisk variasjon. Dette medfører at påfølgende resultater hos et individ kan variere med 100–200 % uten at dette nødvendigvis betyr noen endring i pasientens kliniske tilstand. Denne naturlige variasjonen er typisk mest uttalt ved lave og lett forhøyede verdier. Denne naturlige variasjonen er bakgrunnen for at det anbefales å ta flere prøver på forskjellige dager, særlig dersom albuminutskillelsen bare er lett forhøyet.
Nærmere råd for oppfølging av pasienter med nyreskade er gitt i anbefalingene Henvisning av pasienter med nyreskade til nefrolog og Oppfølging av pasienter med lav GFR for å redusere risiko for kardiovaskulær sykdom - "Vær varsom"-plakaten
Økt albuminutskillelse i urinen (albuminuri) er et tidlig tegn på nyreskade (nefropati) og en risikomarkør for hjerte- og kar sykdom. Kvantitering av AKR brukes derfor både som et diagnostikum (diabetisk nefropati eller annen nyresykdom) og som mål på progresjon av nyreskade (økende albuminuri).
Ved diabetes nefropati opptrer ofte økning i albuminutskillelse samtidig med utvikling av diabetisk retinopati eller andre tegn på mikrovaskulære komplikasjoner. Ved fravær av retinopati bør annen årsak til nyreskade vurderes, spesielt ved diabetes type 2. Nivået av albuminuri (høyt eller lavt) er et viktig prognostisk tegn på utvikling i nyreskaden.
Måling av albumin/kreatinin-ratio (AKR) vil være et viktig hjelpemiddel for å kunne bedømme den enkelte pasient med hensyn til fare for utvikling av kronisk nyresykdom, også for fremtidig hjerte-karsykdom.
AKR må bedømmes kvantitativt, ikke kvalitativt (dvs. semikvantitativ metode for urin albumin bør ikke benyttes da disse ikke gir nøyaktig verdi og vanlig urinstix kan ikke brukes da disse ikke gir positivt utslag før albuminkonsentrasjonen er betydelig forhøyet). Urinstix har for lav sensitivitet (nedre deteksjonsgrense for albuminkonsentrasjon i urin målt ved urinstix er ca. 150 mg/L). Målingen inngår som en obligat del av diabetesjournalen og har behandlingsmessige konsekvenser. For pasienten vil det være en fordel å kunne levere spotprøve heller enn samleurin, noe som i seg selv også vil være kostnadsbesparende.
Det er ikke utført randomiserte undersøkelser som direkte sammenligner bruk av spoturin mot samleurin for prediksjon av fremtidig nyre- eller hjerte-karsykdom. Evidensgrunnlaget for anbefalingen om målemetode for albuminuri er derfor basert på korrelasjonsstudier og retrospektive samlekohorter. Disse gjengis i sammendraget.
Forebygging av nefropati, enten definert som moderat forhøyet albuminuri og/eller betydelig forhøyet albuminuri, er et prioritert mål i behandlingen av diabetes type 1. Dette vil på sikt kunne forhindre hypertensjon, fall i nyrefunksjon (glomerulær filtrasjonsrate, GFR), og sekundært til fall i GFR også forebygging av kardiovaskulær sykdom.
AKR-måling er en kostnadsfaktor i laboratoriet. Hos personer med normale verdier er det tilstrekkelig å måle én gang årlig. Pasienter med forhøyet eller stigende albuminuri vil kreve hyppigere monitorering, men til gjengjeld vil god behandling ut fra albuminuri-målinger kunne forebygge mer kostnadskrevende sykdom på sikt (kronisk nyresykdom, hjerte-karsykdom). For pasienten vil dette ubetinget være en fordel.
Det er ikke utført randomiserte undersøkelser som direkte sammenligner ulike metoder å bestemme urin albuminutskillelse på (f.eks. bruk av spoturin vs. samleurin) for prediksjon av fremtidig sykdom (nyresykdom, hjerte-karsykdom).
En større systematisk oversiktsartikkel publisert i 2004 (Ewald et al 2004) har undersøkt samsvaret mellom urinsamlinger og spotprøver (AKR eller konsentrasjonsmåling av urin-albumin i morgenurin) for diabetespasienter i allmennpraksis; totalt 10 studier ble inkludert. Effektmålet var diagnostisk odds ratio (sanne positive x sanne negative / falske negative x falske positive). Man fant en høy DOR (ca. 90), noe som betyr at AKR i spotprøver er en effektiv metode sammenlignet med urinsamlinger. Sensitivitet og spesifisitet for diagnosen albuminuri var > 80% i de fleste studier, men poolede data for dette er ikke gitt.
En annen stor systematisk oversiktsartikkel (Wu et al 2014) har sammenlignet vanlige konsentrasjonsmålinger (mg/L) og AKR (mg/mmol kreatinin) i tilfeldige urinprøver mot 24 timers urinsamlinger (gullstandard) mtp effektivitet ved screening for albuminuri hos pasienter med diabetes. 14 studier (n=2078) ble inkludert, og gjennomsnittsprevalensen av albuminuri var 33 %. Pooled sensitivitet og spesifisitet var 0,85 / 0,88 og 0,87 / 0,88 for hhv konsentrasjonsmåling og AKR. DOR og AUC var høyest for AKR (46,4 vs 39,7 og 0,94 vs 0,91). Tidspunktet for prøvetakning ila dagen påvirket ikke påvist sensitivitet/spesifisitet.
Det ser derfor ut som disse testene er ganske likeverdige mtp screeningformål, og at prøvetakingstidspunkt er mindre vesentlig enn tidligere antatt. Forfatterne understreker likevel at et positivt resultat ved screening bør verifiseres enten med samleurinprøve eller repeterte målinger.
I tillegg vurderes en oversiktsartikkel publisert i 2009 (Miller et al., 2009). Artikkelen viser at biologisk variasjon (fysiologiske endringer hos stabile pasienter) er minst ved undersøkelse av urin albumin/kreatinin ratio i morgenprøver sammenlignet med andre metoder. Dette er bakgrunnen for at AKR og morgenurin anbefales, da redusert variabilitet er en fordel for analyseresultater som benyttes til monitorering.
371. Ewald, B. and Attia, J. Which test to detect microalbuminuria in diabetic patients? A systematic review. Aust Fam Physician. 2004. 33. 7. 565-567, 571.
372. KDIGO 2012. Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. 2012. 3 Suppl 1. 63-90.
373. McTaggart, M.P., et al. Diagnostic accuracy of point-of-care tests for detecting albuminuria: a systematic review and meta-analysis.. Ann Intern Med. 2014. 160. 8. 550-557.
374. Miller, G., et al. Current Issues in Measurement and Reporting of Urinary Albumin Excretion. Ann Biol Clin (Paris). 2010 Jan-Feb. 68. 1. 9-25. doi: 10.1684/abc.2010.0402.
375. Wu, D., et al. Age- and gender-specific reference values for urine albumin/creatinine ratio in children of southwest China. Clin Chim Acta. 2014. 431. 239-243.
Til laboratoriet:
Til fastlegen:
Ved raskt fallende eGFR eller stigende AKR-verdier bør eGFR bestemmes hyppigere. Se Algoritme for vurdering av eGFR og u-AKR ved diabetes.
CKD-EPI- og MDRD-kalkulator. Velg CKD-EPI CREATININE EQ (2009) for kalkulering av CKD-EPI.
Store proteinrike måltider <12 timer før prøvetaking kan gi falskt høye eGFR-verdier. Hos pasienter med unormal høy eller lav muskelmasse er eGFR verdiene usikre, stor muskelmasse gir falsk lave eGFR-verdier, mens lav muskelmasse gir falsk for høye verdier. Ved tolkning av påfølgende eGFR-resultater er det viktig å være klar over at disse hos enkeltindivider kan variere med inntil 10-15 % på grunn av biologisk og analytisk variasjon.
| GFR-kategori | Nyrefunksjon | Glomerulær filtrasjonshastighet (ml/min/1.73 m²) |
| G1 | Normal | >90 |
| G2 | Lett redusert* | 60-89 |
| G3a | Lett til moderat redusert | 45-59 |
| G3b | Moderat til betydelig redusert | 30-44 |
| G4 | Betydelig redusert | 15-29 |
| G5 | Terminal nyresvikt | <15 |
*Hos eldre reduseres nyrefunksjon årlig med 0,5-1 ml/min/1.73 m². eGFR i området 60-89 ml/min/1.73 m² anses normalt for eldre mennesker.
Pasienter med diabetes utvikler hyppig komplikasjoner i form av redusert nyrefunksjon. Nyrefunksjon måles ved å bestemme glomerulær filtrasjonsrate (GFR). Gullstandard for GFR måling gjøres ved å injisere et inert stoff som man deretter måler nyrenes evne til å filtrere. Nøyaktig måling av GFR er omstendelig og krever flere timers undersøkelse ved nyrefysiologisk laboratorium eller nukleærmedisinsk avdeling (iohexol-clearance, EDTA-clearance, DTPA-clearance).
Den vanligste metoden er derfor å måle konsentrasjonen av ulike endogene stoffer som produseres med konstant rate, filtreres fritt over glomerulusmembranen og i liten grad absorberes eller sekreres i nyretubuli. Den klart vanligste av disse parameterne er kreatinin. Kreatinin er et nedbrytningsprodukt fra muskulatur som frigis kontinuerlig, og konsentrasjonen av kreatinin er derfor avhengig av pasientens muskelmasse og nyrefunksjon. Gjennomsnittlig muskelmasse varierer basert på alder og kjønn. Kvinner og eldre har som regel lavere kreatininkonsentrasjon enn menn ved samme grad av nyrefunksjon.
For å gjøre tolkningen av kreatinin-verdier lettere er det laget ulike formler der en estimerer GFR (eGFR) for ulike kreatininverdier hos pasienter med ulik alder og kjønn. Det fins flere ulike formler for å beregne eGFR basert på kreatininkonsentrasjonen. Formlene har for ulike populasjoner av pasienter varierende grad av overenstemmelse med gullstandard nyrefunksjonsmåling og varierende prognostisk informasjon. I Norge benyttes primært kreatinin-baserte estimat av GFR. Lave verdier av eGFR øker risikoen for raskere fall i nyrefunksjon, og kan også påvirkes av interkurrente ikke-renale tilstander. Derfor bør eGFR <60 ml/min/1.73 m2 kontrolleres innen 3 måneder (se algoritme). Vær oppmerksom på at eGFR spesielt hos eldre mennesker temporært kan være lavere på grunn av nedsatt væskeinntak eller interkurrent sykdom. Stabile verdier over tid kan kontrolleres sjeldnere. Ved påvisning av eGFR <60 ml/min/1.73 m2 hos ny pasient bør denne verdien kontrolleres inn 2 uker, og pasienter med raskt fall i eGRF (>20%) henvises til nyrespesialist (se algoritme).
Bestemmelse av nyrefunksjon og klassifisering av ev. nyresykdom hos diabetespasienter er essensielt for å kunne gi en best mulig bedømmelse av risiko for kronisk nyresykdom og hjerte-karsykdom. Dette vil på sin side bestemme behandlingsvalgene for pasienten.
Estimering av GFR utføres Norge ved to alternative kreatinin-baserte formler, den klassiske MDRD-formelen og den nye CKD-EPI-formelen. CKD-EPI-formelen ser ut til å gi en bedre prediksjon for nyresykdom og hjerte-kar dødelighet enn MDRD-formelen hos pasienter som har estimert GFR 45-90 ml/min/1.73 m2. Mer utstrakt bruk av CKD-EPI-formelen vil kreve at flere norske laboratorier forandrer sine utregninger i henhold til denne metoden.
Målemetode for eGFR lar seg vanskelig evaluere ut fra GRADE metodikk. Vi har derfor vurdert retrospektive analyser på samlekohorter.
Evidensgrunnlaget for anbefalingen av CKD-EPI eller MDRD formel som egnet metode for å predikere fremtidig nyresykdom og hjerte- kardødelighet, er basert på retrospektive samlekohorter. Disse gjengis i sammendraget.
Ingen av de utvalgte studiene er spesifikke for pasienter med diabetes, men inngår som en subpopulasjon i totalanalysen. Siden antallet diabetespasienter i disse analysene er ganske få, har vi valgt å basere våre anbefalinger på data fra totalpopulasjonen, hvor de fleste ikke har diabetes. Dette gjør at våre anbefalinger på dette punkt har begrenset styrke for personer med diabetes.
Oppfølging av pasientens nyrefunksjon gjøres på en enkel måte med estimert GFR (eGFR). Dette er i klinikken en rimelig og praktisk metode og medfører ingen ekstra belastning for pasientene. Estimatet gir ikke bare et mål på utvikling av nyresvikt, men også risiko for fremtidig hjerte-karsykdom. Alternativet til eGFR er kvantitativ måling av GFR, som er en ressurskrevende og kostbar teknikk. Den gjøres kun i sykehus og spesialisthelsetjeneste, og utføres kun på spesiell indikasjon.
Estimering av GFR basert på kreatinin-målinger krever kun opplysning om pasientens kjønn, alder og aktuelle kreatinin-verdi. Kostnaden baserer seg derfor til selve kreatinin-målingen, i tillegg til selve datavaren som beregner GFR-verdien. Dette er en lavkostnad analyse med stor nytteverdi for å forutsi pasientens prognose for utvikling av kronisk nyresykdom eller hjerte-karsykdom.
Gruppen har vurdert følgende utfallsmål som kritisk eller viktig:
Død, CVD og ESRD predikert med hhv. CKD-EPI- og MDRD-formelen lot seg vurdere i følgende arbeider:
1. (Matsushita, K et al, 2012)
PICO-analysen baserer seg på denne studien, som er en samleanalyse av 1.1 millioner mennesker rekruttert fra bakgrunnspopulasjonen og fra definerte høyrisikopopulasjoner. CKD-EPI-formelen viser bedre prediktivitet for ESRD og kardiovaskulær død sammenlignet med MDRD-formelen når eGFR er 45-90 ml/min/1.73 m2 (CKD stadium 3A og 2). Analysen omfatter personer med og uten diabetes.
2. (Targher ,G. et al, 2012)
Undersøkelsen følger 2.823 personer med diabetes type 2 i 6 år. CKD-EPI predikerte kardiovaskulær død og død uansett årsak bedre enn MDRD-formelen.
I tillegg ble nøyaktigheten ved bruk av hhv CKD-EPI- og MDRD-formelen og ulike kreatininmetoder analysert mot målt GFR i:
Undersøkelsen omfatter et samlet datasett på 3.896 personer fra tilsammen 16 studier. CKD-EPI-formelen ga mer nøyaktig estimat av GFR enn MDRD-formelen ved alle målte GFR >30 ml/min/1.73 m2 (lavere bias). Bias var lavere opp til målt GFR 119 ml/min/1.73 m2. Undersøkelsen omfattet vesentlig personer uten diabetes, kun 28% hadde diabetes (Stevens, L.A., et al, 2010).
Vedrørende bruk av kreatininmetode har flere studier vist at enzymatisk kreatininmetode gir best samsvar med referansemetoden for kreatinin (Greenberg et al 2012, Kuster et al 2014), og KDIGO guidelines angir at denne metoden er å foretrekke. Det er også vist at andre metoder ikke alltid oppfyller kravene til analytisk kvalitet, dette gjelder også IDMS sporbare Jaffe metoder (Kuster et al 2014).
372. KDIGO 2012. Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. 2012. 3 Suppl 1. 63-90.
376. Matsushita, K., Mahmoodi, B.K., Woodward, M., & et al. Comparison of risk prediction using the ckd-epi equation and the mdrd study equation for estimated glomerular filtration rate. JAMA. 2012, 307(18), 1941-1951. doi: 10.1001/jama.2012.395.
377. Greenberg N, Roberts WL, Bachmann LM, Wright EC, Dalton RN, Zakowski JJ, Miller WG. Specificity characteristics of 7 commercial creatinine measurement procedures by enzymatic and Jaffe method principles.. Clin Chem. 2012 Feb;58(2):391-401. doi: 10.1373/clinchem.2011.172288. Epub 2011 Dec 13..
378. Kuster, N., et al. Enzymatic creatinine assays allow estimation of glomerular filtration rate in stages 1 and 2 chronic kidney disease using CKD-EPI equation. Clin Chim Acta. 2014. 428. 89-95.
379. Stevens, L. A., Schmid, C. H., Greene, T., Zhang, Y. L., Beck, G. J., Froissart, M., Levey, A. S. Comparative performance of the CKD Epidemiology Collaboration (CKD-EPI) and the Modification of Diet in Renal Disease (MDRD) Study equations for estimating GFR levels above 60 mL/min/1.73 m2. Am J Kidney Dis. 2010. 56. 3. 486-495.
380. Targher,G., Zoppini, G., Mantovani, W., Chonchol, M., Negri, C., Stoico, V., Bonora, E. Comparison of two creatinine-based estimating equations in predicting all-cause and cardiovascular mortality in patients with type 2 diabetes. Diabetes Care. 2012. 35. 11. 2347-2353.
381. Lennart Tonneijck, Marcel H A Muskiet, Mark M Smits, Erik J van Bommel, Hiddo J L Heerspink, Daniël H van Raalte, Jaap A Joles. Glomerular Hyperfiltration in Diabetes: Mechanisms, Clinical Significance, and Treatment.. Journal of the American Society of Nephrology : JASN. 2017. 28. 4. 1023-1039. 10.1681/ASN.2016060666.
382. Vivette D D'Agati, Avry Chagnac, Aiko P J de Vries, Moshe Levi, Esteban Porrini, Michal Herman-Edelstein, Manuel Praga. Obesity-related glomerulopathy: clinical and pathologic characteristics and pathogenesis.. Nature reviews. Nephrology. 2016. 12. 8. 453-71. 10.1038/nrneph.2016.75.
Henvis til eller konferer med nefrolog ved:
Akutt nyresvikt. Hyppigste årsak er interkurent sykdom og dehydrering med forverring av nyrefunksjon på grunn av legemidler som Ikke-steroide antiinflammatoriske midler (NSAID (M01A)), diuretika, ACE-hemmere (ACE-i) (C09AA), eller Angiotensin II-reseptorantagonister (ARB) (C09CA) (se Oppfølging av pasienter med lav GFR for å redusere risiko for kardiovaskulær sykdom – «Vær varsom»-plakaten). Dårlig pasient som ikke skal behandles i allmennpraksis legges inn som øhj. Henvis urolog ved avløpshinder som ikke behandles i allmennpraksis.
Mistanke om annen nyresykdom enn diabetes nefropati dersom: Plutselig oppstått proteinuri (urin protein stiks 2-3+), hematuri, fravær av retinopati, kort varighet av diabetes (type 1).
Hyperkalemi. Ta blodprøve uten venestase, seponer eller reduser kaliumtilskudd, ACEi eller ARB, kaliumsparende diuretika, gi beskjed om kaliumredusert kost (unngå cola, kaffe, nøtter, tørkede frukter, kakao). Konferer eventuelt med nefrolog eller klinisk ernæringsfysiolog.

Formål med henvisning av pasienter med diabetes og nyreskade til nefrolog er at man ved samarbeid kan:
20 % av alle med diabetes type 2 har GFR <60 ml/min/ 1.73 m² (Koro CE, 2009). Disse trenger spesiell oppfølging med hensyn på forverring av nyreskade, og også kardiovaskulær risiko. Ved god oppfølging og kontroll av pasientene kan utviklingen av nyresvikt bremses, hvilket vil kunne redusere komplikasjoner og mortalitet (Rayner HC, 2011 og 2014). Ved etablert nefropati er godt regulert blodtrykk viktigst for å bremse progresjon av nyresvikt. Hos pasienter med diabetes type 2 er nefrosklerose (hypertensiv nyreskade) en like hyppig årsak til nyresvikt som diabetes nefropati.
367. Rayner, H.C., et al. Does community-wide chronic kidney disease management improve patient outcomes?. Nephrol Dial Transplant. 2014 Mar;29(3):644-9. doi: 10.1093/ndt/gft486. Epub 2013 Dec 10..
368. Rayner, H.C., Hollingworth, L., Higgins, R., Dodds, S. Systematic kidney disease management in a population with diabetes mellitus: turning the tide of kidney failure. BMJ Qual Saf. 2011;20:903e910. doi:10.1136/bmjqs-2011-000061.
369. Koro CE, et al.. Antidiabetic medication use and prevalence of chronic kidney disease among patients with type 2 diabetes mellitus in the United States. Clin Ther. 2009. 31. 11. 2608-2617.
372. KDIGO 2012. Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. 2012. 3 Suppl 1. 63-90.
383. Vlado Perkovic, Rajiv Agarwal, Paola Fioretto, Brenda R Hemmelgarn, Adeera Levin, Merlin C Thomas, Christoph Wanner, Bertram L Kasiske, David C Wheeler, Per-Henrik Groop, . Management of patients with diabetes and CKD: conclusions from a "Kidney Disease: Improving Global Outcomes" (KDIGO) Controversies Conference.. Kidney international. 2016. 90. 6. 1175-1183. 10.1016/j.kint.2016.09.010.
Eldre skrøpelige pasienter med nyre- og hjertesykdom og diabetes har betydelig økt risiko for alvorlige legemiddelassosierte komplikasjoner. Dehydrering og interkurrent sykdom med manglende væskeinntak er en hyppig årsak til hospitalisering med akutt nyresvikt og hyperkalemi. De viktigste legemidlene som utløser dette er diuretika, ACEi/ARB, og kaliumtilskudd. Interkurrent sykdom kan utløse akutt nyresvikt som ved samtidig bruk av metformin kan utløse en livstruende laktacidose.
Enkle tiltak kan redusere risiko for slike komplikasjoner. Det anbefales at behandlende lege informerer pasienten om risiko og forebyggende tiltak:
Kombinasjonsbehandling gir alltid økt risiko for interaksjoner. Vurder pasientens legemidler ved 20% rask reduksjon i eGFR (innenfor uker eller måneder). Dette kan spesielt skje etter oppstart av ACEi/ARB, diuretika eller SGLT2-hemmer. Vurder også pasientens legemidler ved overgang fra nyresvikt grad 3a (45-60ml/min/1.73 m²) til 3b (30-45 ml/min/1.73 m²) og overgang til grad 4 (15-30 ml/min/1.73 m²). Ved fall av eGFR til < 20 ml/min/1.73 m² vurder nytten av ACEi/ARB opp mot ulempe og risiko, søk råd hos nefrolog. De vanligste legemidlene som trenger dosereduksjon eller seponering er:
Det å ha diabetes innebærer økt risiko for kardiovaskulær sykdom (hjertesykdom og slag). Risiko for mortalitet blant pasienter med og uten diabetes øker med 45 % når eGFR er 45 ml/min/1.73 m² sammenlignet med eGFR høyere enn 60 ml/min/1.73 m². Studier (van der Velde M, 2001) tyder på at denne risikoen kan være opptil 3 ganger økt ved diabetes og avansert nyresvikt (eGFR 15 ml/min/1.73 m²), sammenlignet med diabetes og normal nyrefunksjon. Pasienter med diabetes og nyreskade må følges og behandles spesielt nøye.
370. M van der Velde, et al. Lower estimated glomerular filtration rate and higher albuminuria are associated with all-cause and cardiovascular mortality. A collaborative meta-analysis of high-risk population cohorts. Kidney Int. 2011. 79. 1341-1352.
372. KDIGO 2012. Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. 2012. 3 Suppl 1. 63-90.
384. F Verbeke, et al. A European Renal Best Practice (ERBP) position statement on the Kidney Disease: Improving Global Outcomes (KDIGO) clinical practice guideline for the management of blood pressure in non-dialysis-dependent chronic kidney disease: an endorsement with some caveats for real-life application.. Nephrol. Dial.Transplant. 2014. 29. 490-496.
385. AM Hung, et al. Risk of hypoglycemia after hospital discharge after acute kidney injury in patients with diabetes. Diabetes Care Dis . 2018. 41. 503-512.
386. BO Eriksen, et al. The role of cystatin C in improving GFR estimation in the general population. Am J Kidney Dis . 2012. 59. 32-40.
Hos personer med nedsatt nyrefunksjon (eGFR < 45 ml/min/1.73 m²) bør behandling med aktivt D-vitamin (1,25-OH vitamin D3) startes hvis PTH overskrider det 3-dobbelte av øvre referanseverdi og s-Ca under referanseverdi. Før behandlingen starter må fastlegen konferere med nefrolog.
Behandlingen er oftest aktuell når eGFR < 45 ml/min/1.73 m². Når nyrefunksjonen faller ytterligere vil fosfat-nivåene stige i blodet. Pasienten bør da henvises til nefrolog for vurdering.
Som aktivt D-vitaminpreparat (A11CC) brukes i Norge Rocaltrol eller Etalpha. Pasienten må samtidig ikke bruke andre D-vitaminpreparat. Vanlig dose er 0.25-0.5 ug/ dag.
Siden aktivt D-vitamin utgjør en forsvinnende liten del av total vitamin D kan ikke D-vitaminmålinger i blodet brukes til kontroll. Det er i stedet viktig å måle kalsium og fosfat for å unngå høyt kalsium-fosfat produkt. Stabilisering eller fall i PTH-verdien er også en indikasjon på adekvat behandling. Oppstart av D-vitaminbehandling ved samtidig høy s-fosfat er potensielt farlig, og behandlingen bør i så fall overlates nefrolog.
Nyrene omdanner inaktivt D-vitamin til aktivt 1-alfa hydroksy-vitamin D. Ved nyresvikt reduseres nyrenes kapasitet til denne omdannelsen med påfølgende fare for mangel av aktivt D-vitamin.
Fosfat skilles kun ut gjennom nyrene. Hyperfosfatemi øker risiko for ekstraossøse forkalkninger i arterier og arterioler og derved økt fare for kardiovaskulær sykdom. Kombinasjon av hyperkalsemi og hyperfosfatemi er spesielt ugunstig.
På grunn av redusert sensibilitet av kalsiumreseptorer øker PTH ved nyresvikt. Vi aksepterer derfor verdier av PTH 2-3x normalområdet. Hyperparathyreodisme øker benomsetningen og derved økes risikoen for benbrudd.
372. KDIGO 2012. Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. 2012. 3 Suppl 1. 63-90.
Når andre årsaker til anemi er utelukket, bør erytropoitin-behandling (epo-behandling) startes før Hb er lavere enn 10.0 g/dl. Som hovedregel bør Hb ikke overstige 12.0 g/dl.
Problemstillingen er som regel aktuell når eGFR < 45 ml/min/1.73 m². Behandlingen kan startes i allmennpraksis, men i samråd med nefrolog. Reseptene skrives av spesialist (H-resept).
For å få tilstrekkelig effekt av erytropoietin (B03XA01) bør jernlagrene fylles opp før oppstart med epo. Husk at hos en pasient med nyresvikt kan ferritin være falskt forhøyet (som akutt- fase reaktant). Bruk også øvrige jernparametre som for eksempel serumjern, transferin-metning og reticulocytt-Hb for å bedømme jerndepotene. Peroral jernbehandling kan være utilstrekkelig og erstattes med iv behandling. Dette er som regel en oppgave for nefrolog. Epo gis som sc injeksjon en eller flere ganger per måned, og doseres i forhold til anbefalingen for aktuell preparat.
Anbefalt Hb-konsentrasjon 10-12 g/dl. Hb-verdier høyere enn normal-området (>13-14 g/dl) er forbundet med hypertensjon, samt økt tromboserisiko. Ved Hb over disse nivå er det også rapportert økt forekomst av kardiovaskulære hendelser, hvor røykere er spesielt disponert.
Renal anemi skyldes redusert produksjon av erytropoietin (epo) i nyrer og redusert erytrocytt levetid. Ikke sjelden foreligger blødning fra gastrointestinaltraktus som i stedet er årsak til en blødningsanemi. Dette kan skyldes redusert trombocytt-funksjon, eventuelt betennelsesforandringer i GI-traktus. Før oppstart av epo-behandling skal det gjøres en vanlig utredning av anemi for å utelukke annen årsak enn til anemien.
372. KDIGO 2012. Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. 2012. 3 Suppl 1. 63-90.
Siste faglige endring: 20. desember 2019