Premaligne tilstander kjennetegnes ved at det er histologisk tegn på unormal (atypisk) proliferativ aktivitet enten i gangsystemet (duktalt) eller i de terminale kjertelendestykker (lobulært), men at det ikke er tegn til at epitelceller har brutt gjennom basalmembranen. Hvis et gjennombrudd av basalmembranen identifiseres sikkert og utenfor lobulært stroma, foreligger det et infiltrerende karsinom, og behandlingen skal være deretter.
Normalt har kjertelen to cellelag. Tre eller flere cellelag er uttrykk for en proliferativ aktivitet. Avhengig av proliferasjonsgrad, vevsarkitektur og cellenes atypi kan en skille ut følgende premaligne tilstander:
- Lobulær og duktal epitelhyperplasi uten atypi
- Lobulær og duktal epitelhyperplasi med atypi (ALH og ADH)
- Lobulært (LCIS) og ductalt carcinoma in situ (DCIS) (van Nuys gradering) (Silverstein et al., 1995)
Det er en glidende overgang mellom de forskjellige typer og grader, noe som gjør at en må regne med interobservatør variasjon i histologiske diagnoser.
Dupont og Page (Dupont & Page, 1985) fant følgende kumulative absolutte risiko for mammacarcinom i prosent etter revisjon av vel 10 000 mammabiopsier med mer enn 17 års oppfølgningstid (jfr. tabell 4.1):
Biopsisvar | Risiko for brystkreft | ||
|---|---|---|---|
Etter 10 år | Etter 20 år | Relativ risiko | |
Epitelhyperplasi uten atypi | 3 % | 5 % | 1.6 |
Epitelhyperplasi med atypi | 7 % | 13 % | 4.4 |
Epitelhyperplasi med atypi og samtidig førstegradsslektning med brystkreft | 11 % | 32 % | 8.9 |
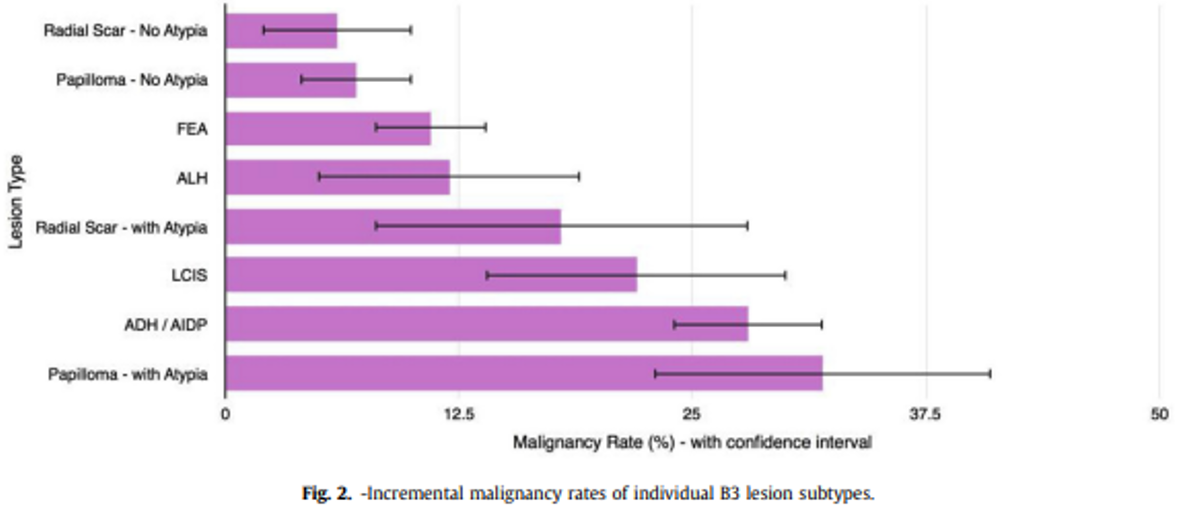
Normalbefolkningens risiko for å utvikle mammakarsinom over en 20-årsperiode fra 35–55 år er ca. 2,5 %, og i perioden 50–70 år 4,8 %. Kvinner med epitelproliferasjon uten atypi har knapt noen høyere risiko enn gjennomsnittet. Det synes derfor ikke å være grunnlag for spesiell oppfølging (Bellini et al., 2023; Rubio et al., 2024).
Risikoen er atskillig høyere for kvinner hvor det er påvist epitelprofilerasjon med atypi, og særlig hvis de har en førstegradsslektning med brystkreft .
Sylindercellelesjoner og Flat epitelial atypi (FEA)
Interessen for disse entitetene har økt fordi de ses hyppigere i screeningprøver. Lesjoner med sylinderepitelkledning i terminale ductolobulære enheter kan deles inn i 3 entiteter; sylindercelleforandringer (columnar cell change), sylindercellehyperplasi (columnar cell hyperplasia) og flat epitelial atypi (FEA) (S. J. Schnitt & Collins, 2005).
Sylindercelleforandringer og sylindercellehyperplasi
(Columnar cell change (CCC) og columnar cell hyperplasia (CCH))
Lesjoner med forstørrede ductolobulære enheter kledt med sylinderepitel uten atypi med henholdsvis 1–2 lag sylinderepitel (CCC) eller > 2 cellelag (CCH)
Disse entitetene beskrives med ulike navn i litteraturen som f eks columnar metaplasia og blunt duct adenosis (S. J. Schnitt & Vincent-Salomon, 2003).
Flat epitelial atypi (FEA)
Lesjoner med forstørrede terminale ductolobulære enheter med ett eller flere lag kubisk eller sylindrisk epitel som viser lavgradig cytologisk atypi (S. Schnitt, Collins, Lakhani, & Simpson, 2019).
«Flat» er en relativ terminologi og indikerer fravær av komplekse strukturer. Sylinderepitellesjoner med lavgradig atypi som danner komplekse strukturer (broer, arkader, mikropapiller) representerer ADH eller DCIS.
Genetiske studier har indikert at FEA er en klonal lesjon som har de samme genetiske forandringer som lavgradig DCIS og tubulært karsinom. Det er også observert en assosiasjon mellom sylinderpitellesjoner/flat epitelial atypi og lobulære neoplasier (LCIS og atypisk lobulær hyperplasi). Utfra disse observasjonene sammen med genetiske data kan man anta at noen av disse lesjonene, i alle fall FEA, er neoplastiske proliferasjoner og kan være forstadier eller tidlige manifestasjoner av lavgradig DCIS og forstadier til invasivt karsinom, spesielt tubulært karsinom (Moinfar, Man, Bratthauer, Ratschek, & Tavassoli, 2000; P. T. Simpson et al., 2005).
Det foreligger svært lav risiko for residiv eller progresjon til kreft når disse opptrer som isolerte lesjoner, men siden FEA oftest ses sammen med andre lesjoner er det vanskelig å si noe om prognose, men WHO working group (2011) mener at FEA utgjør lavere risiko for kreft enn ADH og ALH (de Mascarel, MacGrogan, Picot, Dougazz, & Mathoulin-Pelissier, 2006).
Det bemerkes at columnar cell change og columnar cell hyperplasi og flat epitelial atypi kan forekomme i samme bryst og til og med i samme ductolobulære enhet.
Ved funn av FEA i nålebiopsi bør man skjære dypere snitt for å lete etter assosierte lesjoner. Rutinemessig fjerning av lesjoner med FEA anses ikke nødvendig. Det vil være tilleggsfunn og radiologisk vurdering som bestemmer om det skal gjøres merkebiopsi for å utelukke mer avansert lesjon (S. Schnitt et al., 2019).
Atypisk duktal hyperplasi
Atypisk duktal hyperplasi (ADH) er en intraduktal epitelproliferasjon som delvis har de cellulære og arkitektoniske kjennetegnene til DCIS. Lesjonen defineres også som ADH hvis den har alle morfologiske trekk av lavgradig DCIS, men er < 2 mm i størrelse. Siden forskjellen mellom ADH og DCIS er delvis kvantitativ, skal funn av ADH i grovnålsbiopsi alltid lede til merkebiopsi. ADH har imidlertid så lavt cancerpotensial i seg selv at påvisning i reseksjonsrender i mammaresektat ikke indiserer rereseksjon. Se tabell i kapittel "Oversikt over behandlings- og kontrollforslag ved premaligne tilstander".
Lobulær neoplasi – ALH og LCIS
Preneoplastiske forandringer i kjertellobuli (lobulær neoplasi) er kjennetegnet ved at de terminale kjertelstykkene er overfylt av epitelceller med lav innbyrdes kohesivitet. Det er to hovedtyper, basert på grad av utbredelse i kjertlene: atypisk lobulær hyperplasi (ALH), som kun affiserer en del av lobulus og lobulært carcinoma in situ (LCIS), som affiserer hele lobulus. De prolifererende cellene er oftest immunhistokjemisk negative for markøren E-cadherin.
LCIS deles igjen inn i klassisk, pleomorf, og florid type med comedonekrose (Lakhani et al., 2019):
- Klassisk LCIS har lavgradige kjerner og oppdages praktisk talt alltid tilfeldig i et mammaresektat eller en biopsi gjort for lesjon som er av en annen histologisk type. Den absolutte risiko for utvikling av infiltrerende karsinom ved LCIS er ca. 10 % etter 10 år, 20 % etter 20 år, og ved livstidsobservasjon henimot 30 %. Infiltrerende karsinom hos pasienter med påvist LCIS vil oftest være av duktal type. Risikoen for utvikling av infiltrerende karsinom er like stor i det kontralaterale som i det biopserte brystet. Siden klassisk LCIS (og ALH) er en «systemisk» lidelse i mamma, er det ikke indikasjon for merkebiopsi når det oppdages tilfeldig i grovnålsbiopsi. Unntaket er hvis radiologi og funn for øvrig indikerer en signifikant tilleggslesjon. Kvinnen følges opp med mammografiscreening. Ablatio og profylaktisk antiøstrogen-behandling er ikke aktuelle behandlingsalternativer i Norge. For aktuell referanse, se (Lakhani et al., 2019; Morrow, Schnitt, & Norton, 2015).
- Ved pleomorf LCIS viser cellene uttalt kjerneatypi, og tilstanden er til forveksling lik høygradig DCIS morfologisk. E-cadherin er imidlertid negativ. Siden erkjennelsen av tilstanden er relativt ny, vet vi ikke sikkert den assosierte risiko for invasiv brystkreft. Man regner imidlertid med at risikoen er høyere enn for klassisk LCIS og sannsynligvis like stor som for DCIS. Behandlingen bør derfor tilpasses dette (se fra kapittel "Lokalavansert brystkreft" til kapittel "Kirurgisk behandling av DCIS").
- Florid LCIS med comedonekrose har lavgradige kjerner, men danner tettliggende, meget utvidede kjertelendestykker, ofte med sentral nekrose og kalk. Det er ikke uvanlig at denne tilstanden detekteres ved mammografi. Morfologisk ligner den lavgradig DCIS. Anbefales behandlet som DCIS (se fra kapittel "Lokalavansert brystkreft" til kapittel "Kirurgisk behandling av DCIS"). For aktuell referanse, se (Lakhani et al., 2019; Morrow et al., 2015).
Ad behandling: Det henvises også til WHO-klassifikasjon der utgangspunktet er behandling av b og c som for DCIS (f. eks. render 2 mm), men at det utvises forsiktighet/nøye overveielse ved mer aggressiv terapi (for eksempel ablatio).
Ductalt carcinoma in situ (DCIS)
DCIS, også betegnet intraduktalt karsinom, må ikke forveksles med invasivt karsinom av duktal type. Ved DCIS er melkegangene fylt med carcinomceller og det er ikke infiltrasjon gjennom basalmembranen som omgir gangen. Cellene er oftest immunhistokjemisk positive for E-cadherin.
Forekomst
Tidligere var DCIS en sjelden tilstand og utgjorde kun mellom 1,4 og 5,3 % av alle nydiagnostiserte brystkrefttilfeller. Etter hvert som mammografi er blitt mer utbredt, påvises mistanke om slike forandringer hyppigere (mellom 5–10 %). I områder med etablert mammografiscreening utgjør DCIS 25–30 % av de nye brystkrefttilfeller i første screeningrunde. I senere screening-runder vil andelen være 10–20 %.
Fare for residiv
Hovedproblemet med DCIS er at risikoen for lokalt residiv i brystet etter reseksjon alene er betydelig større enn ved andre premaligne lesjoner i brystkjertelvevet. Risiko for residiv avhenger av flere faktorer, og er større for:
- Palpable enn for ikke-palpable DCIS svulster (Kerlikowske et al., 2003)
- DCIS grad 3 enn for DCIS grad 1 og 2 (Kerlikowske et al., 2003; MacDonald et al., 2005)
- Diffust utbredt enn for mikrofokale
- Hos yngre kvinner (Schouten van der Velden, Peeters, Koot, & Hennipman, 2006)
Størrelse
Det er vist at residivfaren øker med størrelse, men det kan være vanskelig å få gode data på størrelse og residivfrekvens, på grunn av vanskelig målbarhet av lesjonen, ofte flere etterfølgende inngrep og heterogenitet i klassifikasjon og behandling (Bijker et al., 2001; Fisher et al., 2001; Mokbel & Cutuli, 2006; Ottesen, Graversen, Blichert-Toft, Christensen, & Andersen, 2000; G. F. Schwartz, Solin, Olivotto, Ernster, & Pressman, 2000).
Reseksjonskanter
De fleste residiv kommer lokalt i nær tilslutning til det primære arret. Det er i litteraturen bred enighet om at frie reseksjonkanter er viktig for å hindre residiv, men antall mm på reseksjonsmarginene diskuteres (MacDonald et al., 2005; Mokbel et al., 2006; Schwartz et al., 2000). Det anbefales minst 2 mm mikroskopisk avstand fra DCIS (uten samtidig infiltrerende komponent i tumor) til nærmeste reseksjonskant mot omgivende mammavev for å ta høyde for histopatologisk usikkerhet i vurderingen av frie reseksjonskanter. Så kort avstand i definisjonen av fri reseksjonsrand forutsetter nøye histologisk undersøkelse.